Jakie są rodzaje badań naukowych?
Podział badań naukowych: Oto krótka wizualizacja, która może pomóc w zrozumieniu głównych grup padań naukowych:
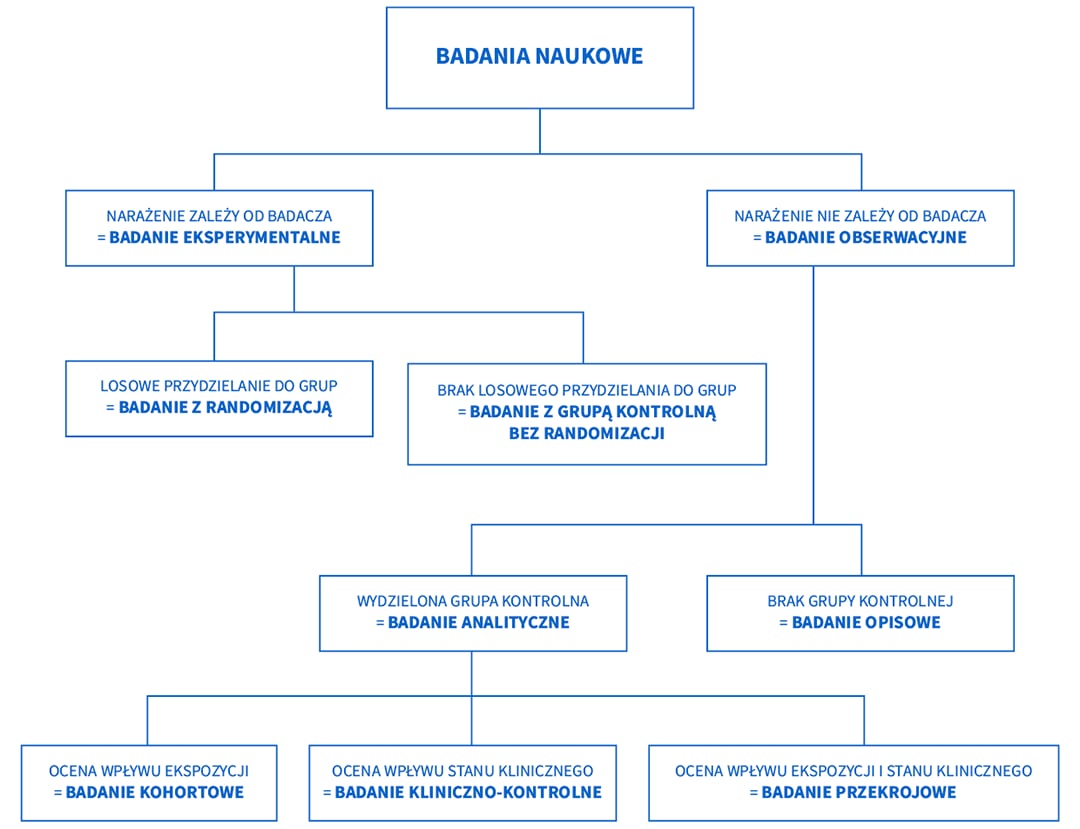
Badanie randomizowane - czym są?
Randomizowane badania kontrolowane (ang. Randomized controlled trial, RCT) to rodzaj badania naukowego, w którym uczestnicy są losowo przydzielani do jednej z dwóch (lub więcej) grup. Jedna grupa zostaje poddana leczeniu eksperymentalnemu (tzw. interwencji); druga to grupa „kontrolna”, która nie jest objęta interwencją. Celem tego rodzaju badań jest ocena skuteczności interwencji, terapii lub procedur w sposób, który minimalizuje wpływ czynników zewnętrznych oraz preferencji uczestników.
Czym wyróżniają się badania randomizowane?
Randomizacja: Uczestnicy są losowo przydzielani do grupy eksperymentalnej (która otrzymuje interwencję) lub grupy kontrolnej (która może otrzymywać placebo lub standardową opiekę, lub inny lek). Dzięki temu możliwe jest zminimalizowanie ryzyka błędu systematycznego i uzyskanie bardziej wiarygodnych wyników.
Grupa kontrolna: W badaniach randomizowanych często istnieje grupa kontrolna, która pozwala na porównanie efektów interwencji z grupą, która jej nie otrzymuje.
Zaślepienie: W wielu badaniach stosuje się także metodę "blind" (ślepa), która polega na tym, że uczestnicy (lub badacze) nie wiedzą, która grupa jest grupą eksperymentalną, a która kontrolną, co dodatkowo minimalizuje stronniczość.
Czemu służy zaślepienie w badaniu klinicznym?
Zaślepienie w badaniu klinicznym to metoda, która ma na celu zminimalizowanie wpływu subiektywnych ocen uczestników, badaczy, statystyków na wyniki badania. W zaślepieniu uczestnicy badania (pacjenci) nie są informowani o tym, czy otrzymują badany lek (terapię) czy placebo, co ma na celu wyeliminowanie ewentualnych oczekiwań dotyczących efektu leczenia.
W jaki sposób można przeprowadzić zaślepienie badania?
Istnieją różne rodzaje zaślepienia:
Zaślepienie pojedyncze (single-blind) - tylko uczestnicy badań nie wiedzą, czy są w grupie otrzymującej leczenie, czy w grupie kontrolnej (otrzymują placebo).
Zaślepienie podwóne (double-blind) - ani uczestnicy, ani badacze prowadzący badanie nie wiedzą, która grupa otrzymuje jaką interwencję. Wzmacnia to obiektywność i rzetelność wyników.
Zaślepienie potrójne (triple-blind) - nie tylko uczestnicy i badacze, ale także osoby analizujące dane nie wiedzą, która grupa otrzymała który rodzaj interwencji.
Zaślepienie jest kluczowe w badaniach klinicznych, ponieważ pomaga w ograniczyć wpływ błędów systematycznych na wyniki, a tym samym na ich interpretację.
Czym jest randomizacja?
Randomizacja to procedura stosowana w badaniach klinicznych, mająca na celu zapewnienie losowego przydziału uczestników do poszczególnych grup badawczych. Jest to kluczowy element metodologiczny mający na celu minimalizację wpływu czynników zakłócających i zwiększenie wiarygodności wyników badania.
Idea randomizacji polega na tym, że uczestnicy badania są losowo przydzielani do różnych grup badawczych, np. grupy otrzymującej lek badany oraz grupy kontrolnej otrzymującej placebo lub standardowe leczenie. Losowy przydział ma na celu zapewnienie równomiernego rozkładu czynników zakłócających między grupami, tym samym grupy powinny być względem siebie podobne pod względem demograficzno-klinicznym, co umożliwia bardziej obiektywne porównanie efektów interwencji.
Dzięki randomizacji możliwe jest również wykrycie ewentualnych efektów placebo lub błędu systematycznego, a także zwiększenie mocy statystycznej badania.
Jakie są rodzaje randomizacji?
Randomizacja prosta - pacjenci są losowo przydzielani do grup badanej i kontrolnej bez żadnych dodatkowych kryteriów.
Randomizacja blokowa - pacjenci są przydzielani do grup w blokach, aby zapobiec nierównomiernemu rozkładowi cech pacjentów w grupach.
Randomizacja stratyfikowana - pacjenci są przydzielani do grup na podstawie wcześniej zdefiniowanych zmiennych stratyfikujących, takich jak wiek, płeć czy stan zdrowia.
Randomizacja wielopoziomowa - pacjenci są przydzielani na różne poziomy eksperymentu, na przykład do różnych placówek medycznych lub lekarzy.
Randomizacja adaptacyjna - proces randomizacji jest zmodyfikowany na podstawie wyników wcześniejszych pacjentów, aby zoptymalizować efektywność badania.
Czy jakiś typ badań jest lepszy od innych?
Badania randomizowane są uważane za "złoty standard" w badaniach klinicznych, ponieważ dostarczają najbardziej wiarygodnych na temat skuteczności interwencji, pozwalając na lepszą kontrolę nad zmiennymi wpływającymi na wyniki. Wśród wszystkich wymienionych badań szczególne miejsce zajmują badania randomizowane. Dlaczego? Tylko wnioski oparte na nich pozwalają na wnioskowanie przyczynowo-skutkowe. Innymi słowy, jeśli chcesz odpowiedzieć na pytanie, czy podanie leku A powoduje np. spadek ciśnienia krwi, należy przeprowadzić randomizowane badanie z grupą kontrolną.
Co zatem z badaniami obserwacyjnymi? Są gorsze?
Badania obserwacyjne pozwalają nam upewnić się co do zaobserwowanego w badaniach randomizowanych efektu. Czasami są jedyną możliwością uzyskania informacji, na przykład dotyczących efektów ubocznych, które mogą pojawić się po dłuższym czasie. Czasami, ze względów etycznych, nie da się przeprowadzić badania randomizowanego z grupą kontrolną.
Zapewne zdarza się że ludzie biorący udział w badaniu rezygnują, lub "wypadają z badania" z powodu znanych i nieznanych przyczyn. Czy takie "dziurawe" dane nadal są wartościowe? TAK, i w takich przypadkach stosujemy głównie podejści o nazwie ITT (intention-to-treat). Istnieje też drugie o nazwie per protocol (PP). Czym one są?
ITT (analiza ITT, intention-to-treat analysis, analiza wyników w grupach wyodrębnionych zgodnie z zaplanowanym leczeniem): Analiza wystąpienia punktów końcowych w grupach, do których badane osoby były wyjściowo przydzielone przez randomizację, niezależnie od tego czy ostatecznie zostały poddane zaplanowanej interwencji, czy nie. Metoda ta pozwala zachować istotę randomizacji, czyli wyjściową równowagę znanych i nieznanych czynników rokowniczych między grupami.
Natomiast w analizie wyników w grupach wyodrębnionych zgodnie z protokołem badania grupy tworzą tylko osoby, które faktycznie zostały poddane (grupa eksperymentalna) i niepoddane (grupa kontrolna) badanej interwencji; w takiej sytuacji wiarygodność wyników jest podważalna, ponieważ nie ma pewności co do wyjściowego podobieństwa porównywanych grup szczególnie pod względem nieznanych czynników rokowniczych
Gdzie szukać badań z randomizacją?
Istnieje wiele baz danych naukowych. Jedną z nich jest baza PubMed, darmowa. Można również skorzystać ze strony wydawnictwa Medycyna Praktyczna. Strona ta zawiera wiele polskich streszczeń najważniejszych badań opublikowanych w obcokrajowych wydawnictwach.
Czym jest przegląd systematyczny?
Przegląd systematyczny jest badaniem wtórnym (podsumowującym wyniki badań pierwotnych), opracowanym zgodnie z rygorystycznymi standardami metodologicznymi, pozwalającymi zminimalizować ryzyko zaistnienia błędów systematycznych (bias). Dlatego też obecnie uważa się, że wyniki przeglądów systematycznych zajmują jedno z czołowych miejsc w hierarchii wiarygodności danych klinicznych.
Czy przeglądy systematyczne są lepsze od zwykłych przeglądów literatury?
Przeglądy systematyczne z definicji (przytoczonej powyżej) są lepszymi podsumowaniami, gdyż muszą uwzględniać wszystkie dostępne dane naukowe na zadany temat. Dzięki temu są mniej podatne na subiektywne preferencje autorów w doborze danych, na których się opierają. Metodologia przeglądów systematycznych eliminuje możliwość podejmowania subiektywnych decyzji przez autorów w kluczowych momentach tworzenia przeglądu. Innymi słowy, autorzy przeglądu systematycznego nie mają możliwości manipulowania wynikami poprzez decyzje metodologiczne. Natomiast zwykłe przeglądy literatury mogą prezentować subiektywny punkt widzenia autorów.
Jak ocenić czy autorzy przeglądu systematycznego faktycznie dobrze wykonali swoje zadanie? – Sprawdź czy badanie zostało zarejestrowane.
Istnieją pewne cechy przeglądu systematycznego, które wskazują na jego dobrą jakość. Jedną z takich cech jest informacja zawarta w tekście, że stworzenie publikacji poprzedziła rejestracja protokołu tej publikacji. Protokół to metodologiczny szkielet, który powstaje przed publikacją, aby jasno określić zasady kierujące tworzeniem publikacji. Opisuje się w nim, jakie decyzje dotyczące tworzenia artykułu będą podejmowane i dlaczego. Stworzenie protokołu świadczy o przemyśleniu artykułu przed jego powstaniem. W idealnej sytuacji taki protokół powinien być dostępny - czy to w repozytorium (np. PROSPERO), albo jako osobna publikacja
Jak ocenić czy autorzy przeglądu systematycznego faktycznie dobrze wykonali swoje zadanie? – Czy autorzy zadali klarowne pytanie zgodne ze schematem PICO
Istnieją pewne cechy przeglądu systematycznego, które wskazują na jego dobrą jakość. Jedną z takich cech jest klarownie zadane pytanie, na które odpowiada publikacja. Jeśli pytanie, na które chcą odpowiedzieć autorzy, nie jest jasno postawione, sens całej publikacji będzie wątpliwy, a jej wnioski bezużyteczne.
PICO

Co to jest punkt końcowy? Jakie mamy rodzaje punktów końcowych?
W badaniach klinicznych jak i przeglądach systematycznych czy wytycznych praktyki klinicznej pojawia się pojęcie punktu końcowego, określanego często z języka angielskiego słowem "outcome" co oznacza "wynik". Czym on jest? Punkt końcowy to z góry określony i mierzalny rezultat - wynik, który służy do oceny efektywności interwencji. Może to być na przykład zmniejszenie objawów choroby, poprawa jakości życia pacjenta, zmniejszenie ryzyka wystąpienia pewnych powikłań lub przedłużenie czasu przeżycia. Punkt końcowy jest kluczowym wskaźnikiem, który pomaga naukowcom i lekarzom ocenić skuteczność danego leczenia oraz porównać wyniki między różnymi interwencjami.
Istnieje kilka rodzajów punktów końcowych, które mogą być stosowane w badaniach klinicznych. Oto kilka przykładów:
- Pierwszorzędowy punkt końcowy - główny punkt końcowy, który ma największe znaczenie dla oceny skuteczności danego leczenia lub interwencji. Np. przeżycie, jakość życia.
- Drugorzędowy punkt końcowy - inaczej zastępczy punkt końcowy lub surogat - marker fizjologiczny lub biochemiczny, którego związek z pierwszorzędowym punktem końcowym wykazano w badaniach obserwacyjnych.
Można także spotkać się z określeniem twardy lub subiektywny punkt końcowy.
- Punkt końcowy twardy: Jest to obiektywny i łatwy do zmierzenia rezultat, np. śmierć pacjenta, nawrót choroby, hospitalizacja
- Punkt końcowy subiektywny: opiera się na ocenie pacjenta lub klinicysty np. poprawa jakości życia, zmniejszenie bólu.
Jak ocenić czy autorzy przeglądu systematycznego faktycznie dobrze wykonali swoje zadanie? – Czy autorzy przeglądnęli przynajmniej 2 bazy danych? Jedna to stanowczo za mało.
Jedną z cech przeglądu systematycznego jest systematyczne poszukiwanie badań odpowiadających na zadane pytanie badawcze. Ta systematyczność odnosi się do przeszukania co najmniej dwóch baz biomedycznych, takich jak Medline via Ovid i Embase. Do innych baz, których przeszukanie jest zalecane, należy Cochrane Library (w szczególności Cochrane Central). W zależności od tematu przeglądu przeszukuje się również inne bazy specyficzne dla danego obszaru, na przykład z zakresu psychiatrii - bazę PsycInfo, a z zakresu pielęgniarstwa - CINAHL.
Jak ocenić czy autorzy przeglądu systematycznego faktycznie dobrze wykonali swoje zadanie? – zwróć uwagę jak autorzy wykonali selekcję badań
Kiedy w bazach danych zaprojektujemy strategię wyszukiwania i odnajdziemy za jej pomocą publikacje, przeprowadzamy selekcję badań. Nie wszystkie odnalezione pozycje w bazie będą odpowiadały na nasze a priori zadane pytanie kliniczne. Dlatego też w oparciu o PICO oraz szczegółowe kryteria włączenia i wykluczenia dokonuje się selekcji artykułów. Najpierw, wyłącznie na podstawie tytułów i abstraktów, podejmujemy decyzję, czy artykuł włączyć do dalszej analizy, czy wykluczyć go z dalszej analizy jako nieadekwatny. W kolejnym etapie dokonujemy selekcji wybranych artykułów z pierwszego etapu na podstawie pełnych tekstów. Po zebraniu pełnych tekstów publikacji, dogłębniej analizujemy pełny tekst (sekcję metodologii, wyników), aby sprawdzić, czy spełnia nasze kryteria włączenia i wykluczenia. Zaleca się, aby selekcję przeprowadzały dwie osoby niezależnie, w celu zapewnienia obiektywności i zwiększenia wiarygodności. Wszelkie niezgodności powinny być przedyskutowane między dwiema osobami lub rozwiązane przez trzecią osobę. Ważnym elementem jest raportowanie wszelkich informacji na każdym etapie, co oznacza, że powinniśmy odnotować, ile rekordów odnaleźliśmy w każdej bazie, ile było duplikatów (czasem te same artykuły są zaindeksowane w kilku bazach), ile rekordów wyłączyliśmy na etapie analizy po tytułach i abstraktach oraz ile ostatecznie włączyliśmy publikacji po etapie analizy pełnych tekstów.
Jak ocenić czy autorzy przeglądu systematycznego faktycznie dobrze wykonali swoje zadanie? – Sprawdź jak dokładnie autorzy opisali włączone badania
Autorzy poprawnie przeprowadzonego przeglądu systematycznego powinni czytelnikom przedstawić włączone badania w dostatecznie szczegółowy sposób. W zależności od tematu przeglądu czytelnicy powinni znaleźć tabele przedstawiającą charakterystykę uczestników badań (ich wiek, płeć, pochodzenie, występowanie dodatkowych chorób, BMI) oraz szczegóły dotyczące interwencji (np. dawka leku, częstość przyjmowania, forma leku, sposób dostarczania leku, czy pacjenci dostawali instrukcje przyjmowania leku, jeśli otrzymywali poradę - kto ją świadczył, jak długo trwała, jakie informacje były przekazywane, jak często, czy pacjenci dostawali ulotki, broszury itp.). W przeglądzie powinno być również opisane, na czym polegała i jak wyglądała równoległa interwencja z placebo/komparatorem oraz jak zmierzono punkty końcowe, jaką metodą i w którym momencie interwencji.
Jak ocenić czy autorzy przeglądu systematycznego faktycznie dobrze wykonali swoje zadanie? – Autorzy muszą ocenić jakość badań na podstawie których sformułowali wnioski
Podczas opracowywania przeglądu systematycznego czy też po prostu analizy publikacji opisującej badanie kliniczne kolejnym etapem jest ocena jakości danych. Jakość danych świadczy o tym, jaka jest nasza pewność, że oszacowanie efektu jest prawdziwe. Przy ocenie jakości danych bierze się pod uwagę ogólną metodykę każdego badania (np. badanie z randomizacją vs badanie obserwacyjne).
W celu zobiektywizowania ocen prowadzonych przez wielu czytelników np. współautorów przeglądów systematycznych dostępne są gotowe narzędzia do oceny poszczególnych rodzajów badań. Są to najczęściej pytania zamknięte lub otwarte pozwalające ostatecznie zaklasyfikować badanie jako bardzo niskiej, niskiej, umiarkowanej, wysokiej jakości.
Jak ocenić czy autorzy przeglądu systematycznego faktycznie dobrze wykonali swoje zadanie? – Sprawdź czy autorzy zadbali by wynotowywanie danych z badań włączonych było wykonane poprawnie
Podobnie jak w przypadku procesu selekcji badań do przeglądu czy oceny ryzyka błędu systematycznego, należy zwrócić uwagę, aby proces ekstrakcji był przeprowadzony przez dwie osoby równolegle i niezależnie. Wszelkie różnice w ich pracy powinny być przedyskutowane, a ostateczna decyzja powinna zostać podjęta na podstawie konsensusu między nimi lub poprzez decyzję trzeciego autora przeglądu.
Dlaczego ważne jest zwracanie uwagę czy badanie jest sponsorowane czy nie?
Jedną z ważnych cech badania, która może wpływać na bardziej optymistyczny wynik, jest istnienie sponsora badania. Zwykle jest to firma, która dostarcza analizowany lek lub urządzenie. Badania wskazują, że sponsorowane badania są zwykle bardziej optymistyczne w przedstawianiu wielkości efektu interwencji (czyli efekt jest większy), w porównaniu do tych, które takiego wsparcia nie otrzymały. O jakości badania i rzetelności jego przeprowadzenia świadczy to, czy autorzy badania jasno stwierdzili, że badanie miało wsparcie ze strony firm lub instytucji. Badania mogą być sponsorowane nie tylko przez firmy, ale również przez organizacje rządowe, międzynarodowe (np. WHO) lub granty badawcze
Czym jest szara literatura? Co ten termin oznacza? Czy jest ważny?
Grey literature, czyli literatura szara, to termin używany w kontekście różnych dziedzin, w tym medycyny, i odnosi się do materiałów informacyjnych, które nie są publikowane w tradycyjnych kanałach wydawniczych, takich jak czasopisma naukowe czy książki. W medycynie literatura szara może obejmować:
- Raporty badawcze - dokumenty przygotowane przez różne organizacje, agencje rządowe, instytuty badawcze itp.
- Prace dyplomowe i doktorskie
- Prezentacje konferencyjne - niepublikowane wystąpienia, plakaty czy materiały z konferencji naukowych
- Dokumenty rządowe - wytyczne, zalecenia czy raporty
- Materiały edukacyjne - broszury, ulotki i inne zasoby przygotowane przez organizacje z obszaru ochrony zdrowia
- Bazy danych - różne formy danych, takie jak rejestry kliniczne
Literatura szara jest ważnym źródłem ponieważ może zawierać cenne informacje, których nie są publikowane w formie publikacji naukowych. Jej analiza może pomóc w lepszym zrozumieniu kontekstu badań, trendów w zdrowiu publicznym oraz w podejmowaniu decyzji klinicznych.
Czym jest konflikt interesów?
Konflikt interesów to sytuacja, w której osoba, instytucja lub organizacja znajduje się w położeniu, w którym różne interesy — osobiste, zawodowe, finansowe lub inne — mogą wpływać na jej decyzje lub działania w sposób, który nie jest zgodny z jej obowiązkami lub etyką. Konflikt interesów może prowadzić do sytuacji, w której korzyści jednej strony mogą zaszkodzić innej stronie, lub w której obiektywność decyzji jest zagrożona przez osobiste lub inne zależności.
Rodzaje konfliktu interesów
Konflikty interesów można podzielić na finansowe i pośrednie. Do finansowych należą: wynagrodzenie za udział w badaniach, honoraria za konsultacje lub eksperckie porady dla producentów medycznych lub firm farmaceutycznych, wynagrodzenia za wykłady, udział w konferencjach lub promowanie produktów, granty na badania, płatne uczestnictwo w posiedzeniach zarządu oraz wszelkie honoraria i prezenty. Pośrednie konflikty interesów obejmują aspekty osobiste (np. wyznanie, poglądy polityczne, zdobywanie awansów związanych z promowaniem konkretnego leku), relacyjne (np. osobiste antypatie, znana rywalizacja, historia współpracy, praca ze współmałżonkiem, obrona osób o wspólnych interesach, znajomość i koleżeństwo), społeczno-polityczne (np. rzecznictwo lub członkostwo w organizacjach rzeczniczych), zawodowe (np. publikacje, granty, nagrody, zaproszenia na wystąpienia, członkostwo w organizacjach, zatrudnienie) oraz intelektualne (np. wyrażone i opublikowane opinie na dany temat, znaczny wkład zawodowy w określonym obszarze tematycznym, "silnie ugruntowane przekonania" mogące wpływać na obiektywizm).
Czym jest błąd systematyczny określany mianem “błędu publikacyjnego” lub “publication bias”?
Publication bias to rodzaj błędu systematycznego związanego z wybiórczym publikowaniem, który może wypaczyć wyniki przeglądu systematycznego to znaczy zawyżyć lub zaniżyć wyniki. Badania o wynikach pozytywnych (czyli potwierdzających hipotezę badawczą) mają większe szanse na publikację niż badania o wynikach negatywnych (czyli niepotwierdzających hipotezy badawczej). Jest to istotny problem w literaturze naukowej, ponieważ może prowadzić do fałszywego obrazu rzeczywistości - gdy w literaturze dominują opublikowane zbiory danych o wynikach pozytywnych, a wyniki negatywne są pomijane lub niepublikowane. Również szybciej są publikowane wyniki pozytywne w porównaniu do badań z wynikami negatywnymi. A także częściej publikowane są wyniki badań na dużych populacjach niż na mniejszych.
Publication bias może mieć różne przyczyny, m.in. brak chęci publikacji przez autorów negatywnych wyników, preferowanie pozytywnych wyników przez czasopisma naukowe, czy też wpływ interesów komercyjnych. Konsekwencje publication bias mogą być poważne, ponieważ niepełny obraz danych naukowych może prowadzić do niewłaściwych decyzji klinicznych, np. w zakresie leczenia pacjentów.
Jak można ocenić występowanie publication bias?
Istnieje kilka metod oceny występowania publication bias w badaniach naukowych. Oto kilka z nich:
Analiza asymetrii wykresu lejkowego. Jedną z najczęściej stosowanych metod jest analiza tzw. Wykresu lejkowego (funnel plot). Jest to graficzne narzędzie, które pozwala na wizualną ocenę symetrii rozkładu wyników badań. Jeśli nie występuje publication bias wyniki wokół oszacowanej wielkości efektu na wykresie układają się symetrycznie (małe badania w większej liczbie w dolnej cześci wykresu, im wyżej tj. Im większa precyzja wyników z badan (tzw. Błąd standardowy) tym badań mniej. Jeśli występuje symetryczność możemy wykreslić na wykreie trójkąt tzw. Odwrócony lejek. Jeśli występuje publication bias, to lejeku może być asymetryczny, z większą liczbą małych badań o pozytywnych wynikach.
Testy statystyczne: Istnieją również różne testy statystyczne, takie jak test Eggera czy test Begg-Mazumdar, które pozwalają na statystyczną ocenę istnienia publication bias na podstawie danych z metaanalizy.
Analiza niepublikowanych danych: W przypadku metaanalizy można także próbować uzyskać dostęp do niepublikowanych danych, np. poprzez kontakt z autorami badań lub instytucjami prowadzącymi badania.
Z jakich linków korzystać do poszukiwania badań?
- Darmowa baza - PubMed
- Darmowa baza - szczególnie dobra do wyszukiwania przeglądów systematycznych Epistemonikos
- Darmowa baza i czytelnia tłumaczeń artykułów - Medycyna Praktyczna
- Poszukiwanie danych naukowych można przeprowadzić w wyszukiwarce - Scholar Google. Jest to znacznie lepsza wyszukiwarka niż "zwykłe google".
Są jakieś zasady żeby wyszukiwać szybko i skutecznie?
Strategię wyszukiwania należy oprzeć na hasłach opisujących pytania badawcze zgodnie z zasadą słowa: synonimiczne łączone są „OR”, a między kategoriami, czyli pomiędzy hasłami opisującymi uczestników badania a interwencją, „AND”.
Przykład: poszukujemy danych na temat tego, czy „ćwiczenia fizyczne poprawiają jakość życia u osób cierpiących na choroby układu sercowo-naczyniowego.
Populacja | Czym łączyć? | Interwencja | Czym łączyć? | Wynik |
Choroby układu sercowo-naczyniowego | AND | Ćwiczenia | AND | Jakość życia |
OR | OR | |||
Choroby serca | Aktywność | OR | ||
OR | OR | Qol (skrót od: Quality of Life) | ||
Choroby naczyń | Sport |
Kiedy nie mam czasu czytać całego przeglądu a chcę wiedzieć jakie są wnioski, a abstrakt nie podaje zbyt wielu szczegółów, co zrobić?
Przeglądy systematyczne Cochrane, opublikowane po 2016 roku, zawsze zawierają tabelę podsumowującą, zwaną „Summary of Findings Table”. Tabela ta zawiera takie elementy, jak charakterystykę pytania badawczego, P (uczestnicy), I (interwencja), C (komparator), O (o co pytamy), efekty interwencji, liczbę uczestników badań oraz jakość dowodów zgodnie z kryteriami GRADE.
Do czego używa się przeglądów systematycznych w praktyce?
Poszukując rozwiązań problemów klinicznych, warto odwoływać się do wyników przeglądów systematycznych (systematic reviews). Korzystanie z przeglądów systematycznych w codziennej pracy lekarskiej ułatwia podejmowanie trafnych decyzji, gdyż "połączenie wyników badań, w których wzięli udział nieco różniący się chorzy lub inaczej zdefiniowano punkty końcowe, umożliwia rozszerzenie wniosków z poszczególnych badań na większą populację, co pozwala na szersze wykorzystanie ich wyników w praktyce".
Aktualne przeglądy systematyczne są podstawą do opracowywania wytycznych praktyki klinicznej i pozwalają lekarzom postępować zgodnie z EBM.
GRADE
GRADE - to stopień pewności co do obserwowanego wyniku
Podejmując wszelkie decyzje w życiu, chcielibyśmy, żeby były one trafne i dobre. Czasami jesteśmy tych decyzji bardziej pewni, że są one właściwe, czasem mamy pewne wątpliwości i wahania. Staramy się opierać nasze decyzje na dostępnych danych – np. robimy rozeznanie cenowe w różnych sklepach chcąc zakupić np. jakiś sprzęt domowy, analizujemy właściwości i parametry, opieramy się na naszym doświadczeniu, preferencjach czy tez opiniach innych.
W opiece zdrowotnej jest podobnie. Pewność co do podejmowanych decyzji w danej sytuacji klinicznej może być różna i zależy ona między innymi od tego jak dobre, wysokiej jakości/pewności mamy dane naukowe potwierdzające, że dane działanie w określonej sytuacji jest właściwe. Pewność określa stopień naszego zaufania do danych tj. wyników z badań. To pytanie na ile możemy być pewni, że wyniki, które przedstawione w badaniu lub badaniach można osiągnąć również w rzeczywistej praktyce klinicznej.
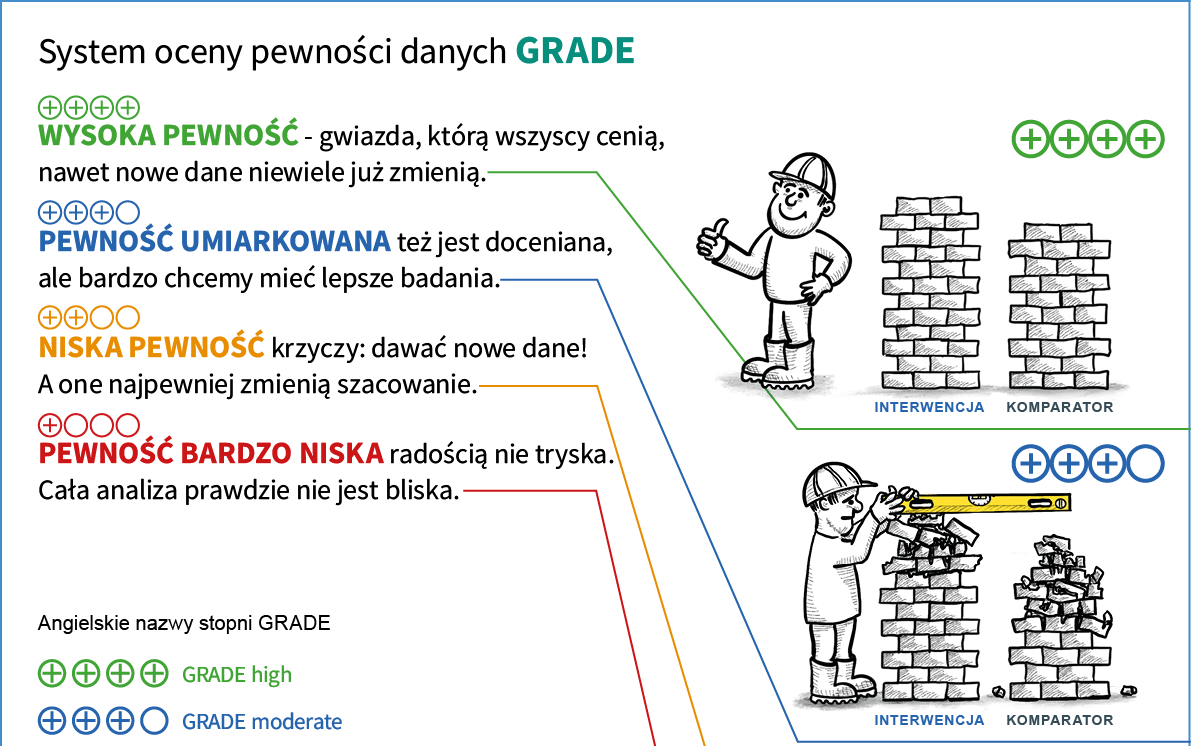
GRADE do określenia tego jak duże mamy zaufanie do danych stosuje 4 kategorie określające jego poziom. Pewność do danych może być:
wysoka – pewność, że prawdziwy efekt jest zbliżony do zaobserwowanego; dalsze badania prawdopodobnie nie zmienią naszego przekonania o trafności oszacowania efektu interwencji
umiarkowana – umiarkowane przekonanie, że prawdziwy efekt jest zbliżony do zaobserwowanego; nowe dane o wyższej jakości prawdopodobnie będą miały istotny wpływ na nasze przekonanie o trafności oszacowania efektu i mogą zmienić to oszacowanie
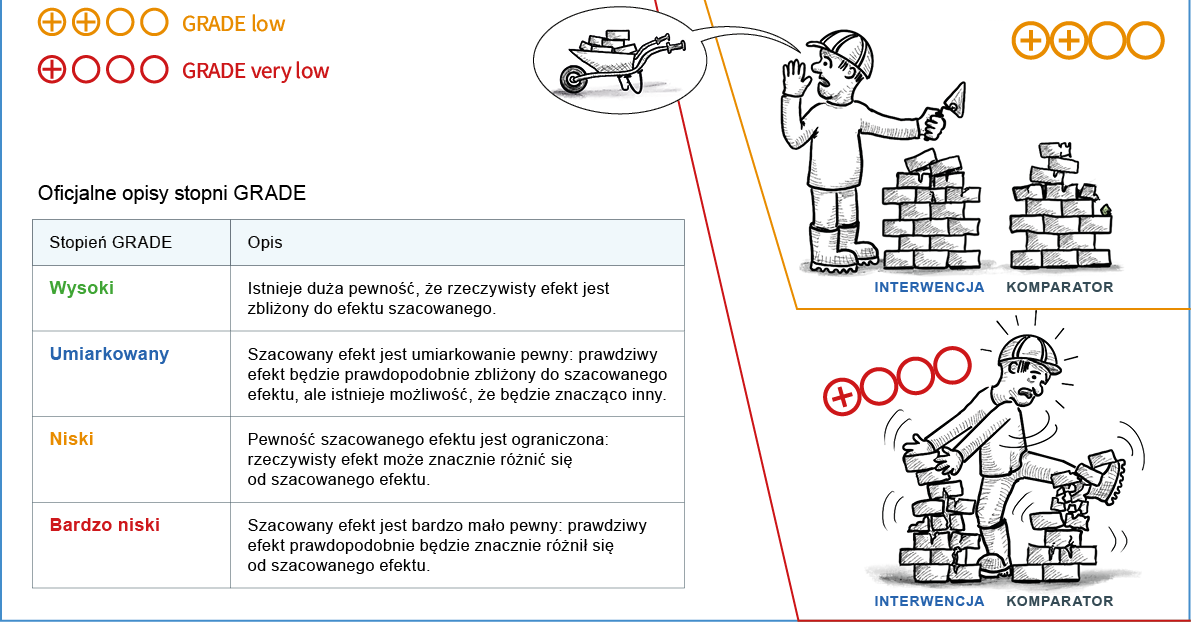
niska – ograniczone przekonanie, że prawdziwy efekt jest zbliżony do zaobserwowanego; prawdziwy efekt może znacznie się różnić od zaobserwowanego; dalsze badania najpewniej będą miały istotny wpływ na nasze przekonanie o trafności oszacowania efektu i najpewniej zmienią to oszacowanie
bardzo niska – bardzo słabe przekonanie, że prawdziwy efekt
jest zbliżony do zaobserwowanego, prawdziwy efekt prawdopodobnie znacznie się różni od zaobserwowanego
Arbitralne klasyfikowanie jakości danych do 4 kategorii jest pewnym ograniczeniem i uproszczeniem. Ale korzyści w postaci prosto ty i przejrzystości takiego rozwiązania przewyższają jego ograniczenia.
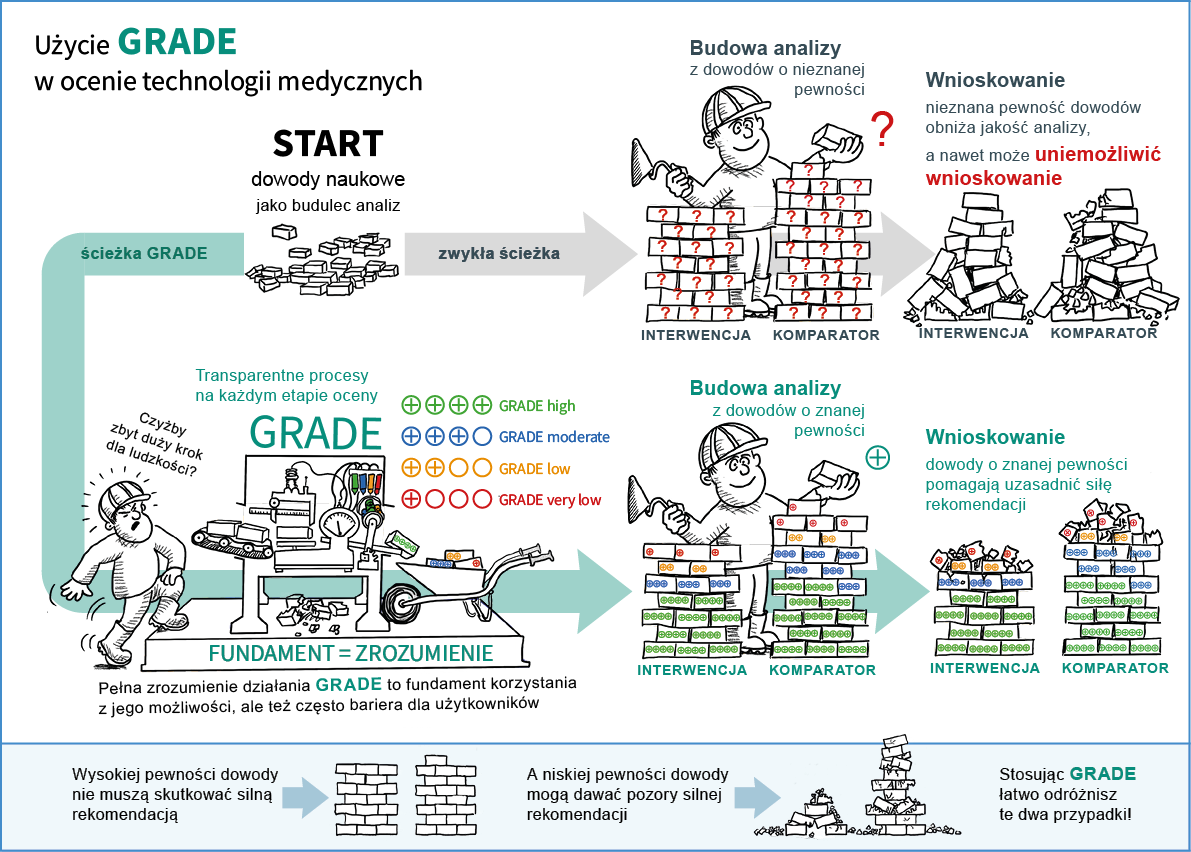
Od czego zależy ocena GRADE – jakie czynniki mogą ją obniżyć w badaniach randomizowanych?
Jednym z pierwszych czynników ocenianych wg metodologii GRADE jest ocena ryzyka popełnienia błędu systematycznego w badaniach, co może wpływać na pewność oszacowań.
Główne ograniczenia badań z randomizacją , które zwiększają ryzyko błędu systematycznego obejmują:
brak utajnienia randomizacji
brak zaślepienia – jego znaczenie jest większe w przypadku subiektywnych punktów końcowych (takich jak np. jakość życia, natężenie bólu) niż przy obiektywnych (np. zgon, zawał serca, udar mózgu, krwawienie)
duży odsetek uczestników, których utracono z obserwacji (lost to follow‑up) np. z powodu rezygnacji z udziału w badaniu, występowania działań niepożądanych, które nie pozwoliły na dalszą kontynuację leczenia, zgon
niezastosowanie analizy zgodnie z zaplanowanym leczeniem (intention‑to‑treat analysis)
wcześniejsze niż zaplanowano przerwanie badania z powodu zaobserwowanej korzyści – z dostępnych danych wynika, że w takich badaniach efekt leczenia jest zawyżony, szczególnie jeśli przed zakończeniem badania zarejestrowano mniej niż 500 zdarzeń. W przypadku przeglądów systematycznych, do których włączono dużo badań zakończonych przedwcześnie, powinno się przeprowadzić analizę wrażliwości polegającą na objęciu analizą wszystkich ba dań, w tym tych zakończonych wcześnie oraz tylko tych badań, których nie przerwano wcześniej. Jeśli oszacowane wyniki różnią się między tymi 2 sytuacjami, powinno się uwzględnić tylko badania, które się nie zakończyły wcześniej, jako bardziej wiarygodne
selektywne raportowanie wyników dla poszczególnych zaplanowanych punktów końcowych. Aby ocenić występowanie tego ograniczenia, konieczne jest sprawdzenie protokołu badania i sprawdzenie czy w publikacji przedstawiono np. tylko cześć wyników, które były zaplanowane w analizie.
Od czego zależy ocena GRADE – jakie czynniki mogą ją obniżyć w badaniach obserwacyjnych?
Główne ograniczenia badań obserwacyjnych obejmują: niewłaściwy dobór grupy kontrolnej oraz nieprzyjęcie odpowiedniej poprawki na brak równowagi między czynnikami prognostycznymi.
Od czego zależy ocena GRADE – czynniki obniżające wynikające z tego, że zadajemy sobie pytanie na które nie ma danych literaturze, a są jedynie na pokrewne, taki brak zgodności między naszym pytaniem a tym co oferują dane z literatury nazywa się indirectness
Dirictness możemy przetłumaczyć jako bezpośredniość. Odnosi się do tego na ile odnalezione badania odpowiadają na nasze pytanie kliniczne. Czy badania opisują tę samą populację Np. Poszukujemy badań dotyczących dzieci z POChP, a odnajdujemy wyłącznie badania wśród dorosłych z PoChP.
Czy interwencja opisywana w badaniach jest taką samą interwencją, która nas interesuje? Czy może np. jest prowadzona przez inny personel? Albo lek podawany jest dożylnie, a my poszukujemy badań o skuteczności leku podawanego doustnie.
Od czego zależy ocena GRADE – czynniki obniżające wynikające z braku precyzji wyników badań jakie możemy odnaleźć, taki problem określamy mianem braku precyzji, określane mianem: imprecision
Metodologia GRADE bierze pod uwagę również to jak bardzo precyzyjne są wyniki poszczególnych badań. Jednym z głównym aspektów precyzji jest to jak liczne były badania. Precyzja wyniku wpływa na nasze zaufanie względem tego, gdzie leży prawdziwy efekt. Im większa precyzja tym większe zaufanie względem wyniku.
Od czego zależy ocena GRADE – czynniki obniżające wiarygodność wnioskowania to m.in. brak spójności pomiędzy włączanymi badaniami, określane mianem: inconsistency
"Jest to rodzaj błędu systematycznego, który zmniejsza stopień spójności wyników badań, a praktycznie powoduje, że wyniki jednych badań wskazują, że interwencja działa korzystnie, a inne mówią coś przeciwnego, mimo iż są to badania dotyczące tego samego zagadnienia. Kiedy wyniki badań wskazują na podobny lub dość zbliżony kierunek efektu, mówimy, że badania są ze sobą spójne. Kiedy wyniki badań, które odpowiadają na to samo pytanie badawcze, wskazują na różne kierunki działania, musimy taki konflikt uwzględnić w naszym wniosku, poprzez obniżenie jego pewności
Od czego zależy ocena GRADE – czynniki zwiększające pewność względem opisywanego wyniku to, m.in. istnienie zależności efektu od dawki
Tak jak istnieją czynniki, które ograniczają nasze zaufanie względem opisywanego wyniku, tak istnieją też takie, które je podwyższają. Jednym z głównych jest istnienie zależności efektu od dawki, czyli kiedy widzimy, że efekt liniowo zwiększa się wraz z podaną dawką. To pozwala nam bardziej zaufać wynikowi, gdyż możemy spodziewać się, że efekt faktycznie jest stabilny.
Od czego zależy ocena GRADE – czynniki zwiększające pewność względem opisywanego wyniku to, m.in. wpływ czynników zakłócających
Naszą pewność co do skuteczności interwencji zwiększa siła związku między interwencją a obserwowanym efektem oraz sytuacja, w której wszystkie potencjalne czynniki zakłócające, mogące obniżyć ten efekt, jednak tego nie osiągają.
Czym jest meta-analiza?
Metaanaliza stanowi ilościową syntezę wyników badań pierwotnych za pomocą odpowiednich metod statystycznych. Warunkiem przeprowadzenia metaanalizy jest jednorodność badań włączonych do przeglądu systematycznego (podobne: badana populacja, interwencja i punkty końcowe lub oceniane zmienne). Graficzną formą przedstawienia wyników metaanalizy jest wykres typu forest plot (wykres drzewkowy, wykres metaanalizy).
Jak czytać meta-analizę?
Metaanaliza stanowi ilościową syntezę wyników badań pierwotnych. Warunkiem przeprowadzenia metaanalizy jest jednorodność badań włączonych do przeglądu systematycznego.
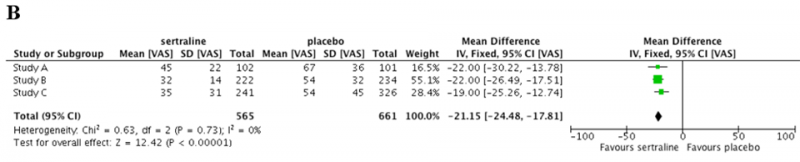
Graficzną formą przedstawienia wyników metaanalizy jest wykres typu forest plot (zwany też wykresem Cochrane’a lub wykresem metaanalizy), dla A). zmiennej dychotomicznej (czyli dla której określamy jedynie jej wystąpienie lub brak wystąpienia- w tym wypadku prawdopodobieństwo ustąpienia objawów choroby) oraz B). dla zmiennej ciągłej (czyli takiej jak np. ciśnienie krwi, innymi słowy takiej zmiennej gdzie możemy się spodziewać rozkładu wartości od mniejszych po większe - w tym przypadku zmiana nasilenia objawów choroby)
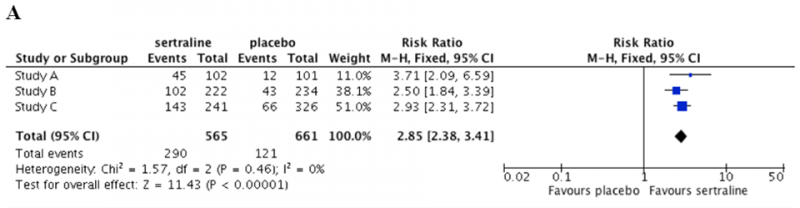
Najważniejszym elementem obydwu wykresów jest kształt diamentu na wykresie, który wskazuje na zsumowany efekt badań które były analizowane (a na wykresie są reprezentowane przez poziome linie z zielonymi kwadracikami pośrodku). Wartości liczbowe, które opisują ten diament znajdują się w ostatniej linii wyników oznaczonej jako "Total". Przeczytajmy zatem wynik meta-analizy na wykresie A: diament leży w całości po stronie wykresu, która jest podpisana jako "Favours sertraline" - czyli po stronie wskazującej na przewagę interwencji (lek) względem placebo dla efektu interwencji, którą w tym wypadku było prawdopodobieństwo ustąpienia objawów choroby). Miarą efektu w tym przypadku jest risk ratio (RR - wytłumaczenie poniżej) o wartości 2,85 - co oznacza, że osoby przyjmujące ten lek mają 2.85 razy większe prawdopodobieństwo ustąpienia objawów choroby w porównaniu do osób przyjmujących placebo. W nawiasie kwadratowym znajdują się wartości [2,38 - 3,41] odnoszące się do 95% CI, czyli 95% przedział ufności (CI, ang. confidence intervals, wyjaśnienie poniżej). Należy go interpretować w następujący sposób: u wszystkich osób, które pasują do populacji biorącej udział w tym konkretnym badaniu (czyli cierpią na tą samą chorobę, znajdują się w podobnym przedziale wiekowym, przyjmujący ten sam lek) należy się spodziewać wzrostu prawdopodobieństwa ustąpienia objawów choroby od 2,38 po 3,41 razy.
Analogicznie w przypadku B). wartości liczbowe opisujące "diament" to -21,15 [-24,48 - -17,81]: u osób przyjmujących lek nastąpiło zmniejszenie nasilenia objawów choroby o 21,15 punktów względem osób nieotrzymujących leku, a w populacji osób o podobnej charakterystyce do tych którzy wzięli udział w tym konkretnym badaniu spadek ten wynosiłby od 24,48 punktów mniej po 17,81 punktów mniej.
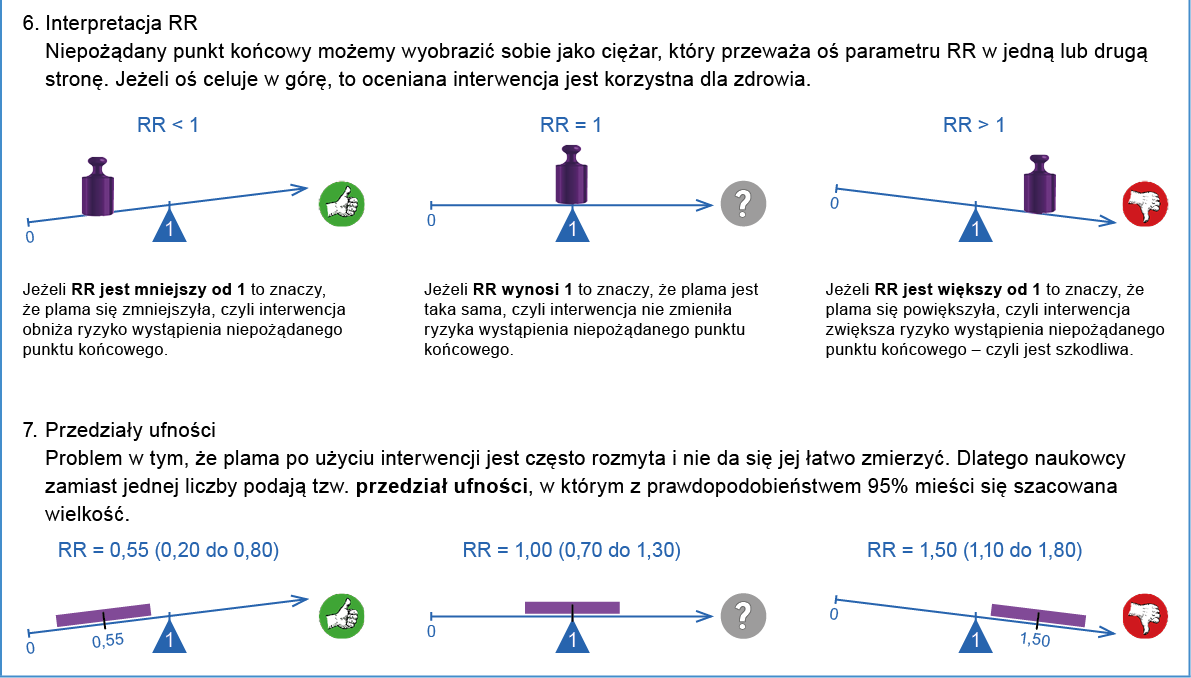
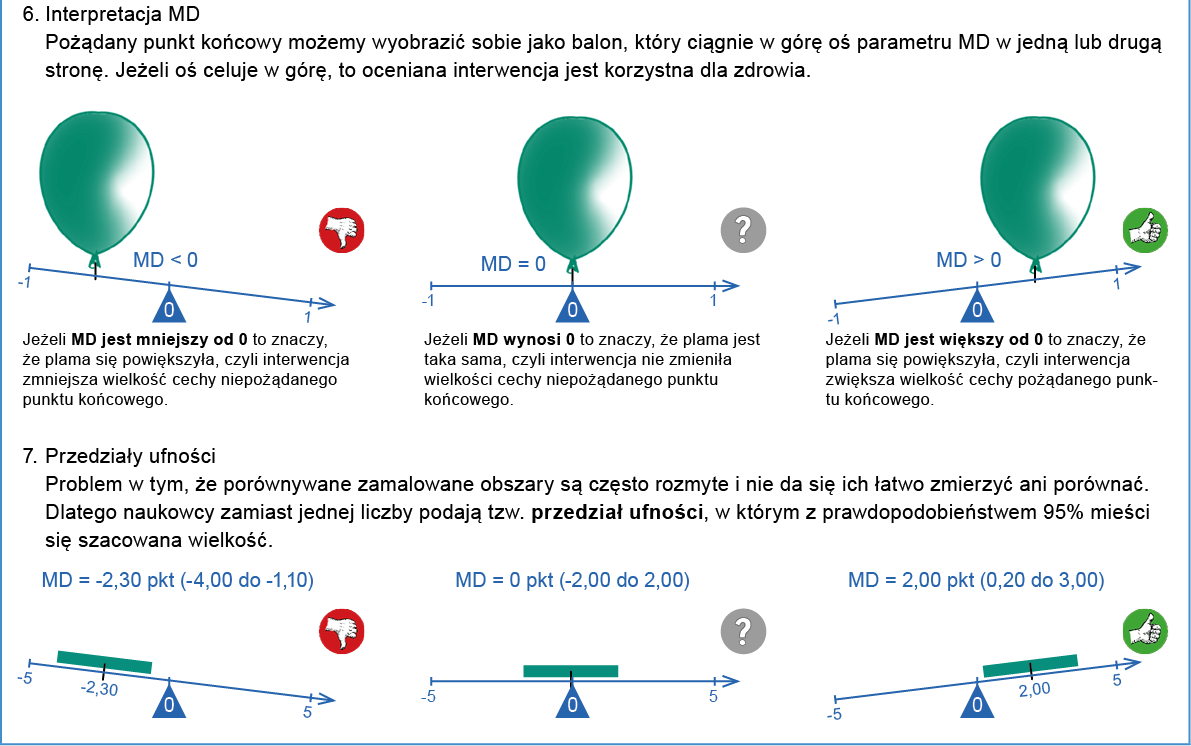
Jak rozumieć przedział ufności (CI)?
Przedział ufności w badaniach klinicznych jest statystycznym pojęciem oznaczającym zakres wartości, w którym z określonym prawdopodobieństwem znajduje się wartość prawdziwa danej zmiennej (np. ryzyka nawrotu).
W kontekście badania klinicznego, przedział ufności jest wykorzystywany do określenia, jak precyzyjne są wyniki badania i jaki może być zakres prawdopodobnego efektu badanej interwencji. Na przykład, jeśli badane jest działanie pewnego leku na obniżenie ciśnienia krwi, to przedział ufności może pomóc określić, w jakim zakresie znajduje się rzeczywisty efekt terapeutyczny tego leku.
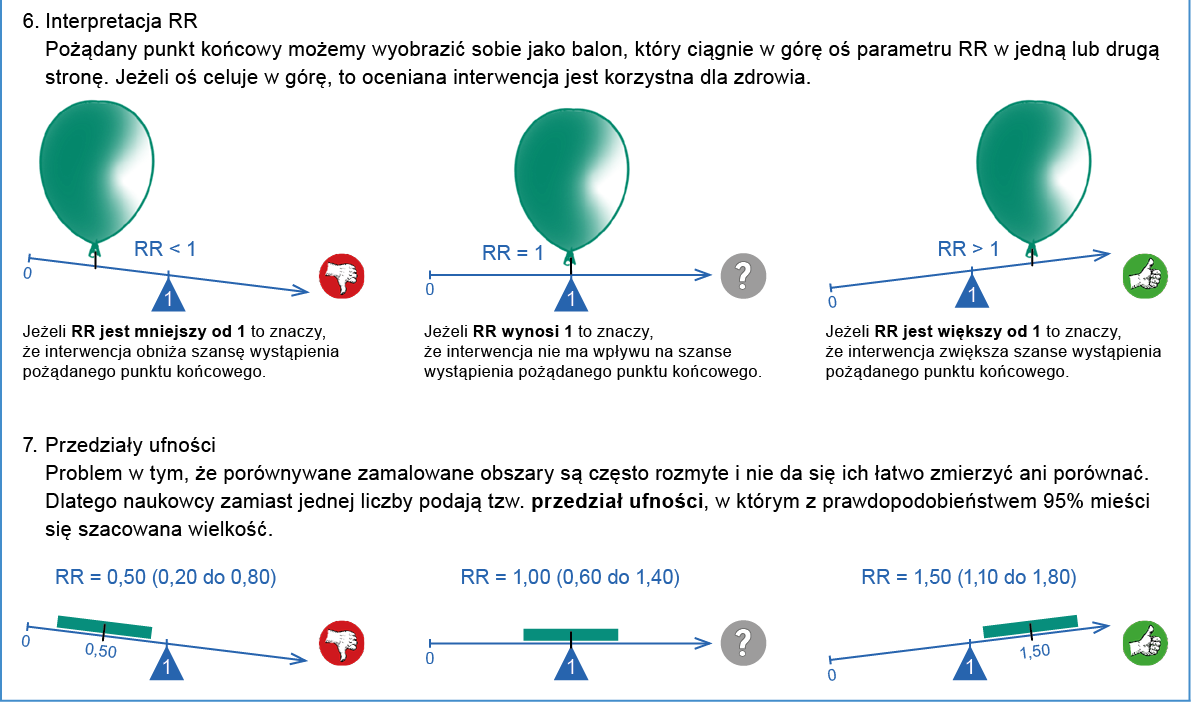
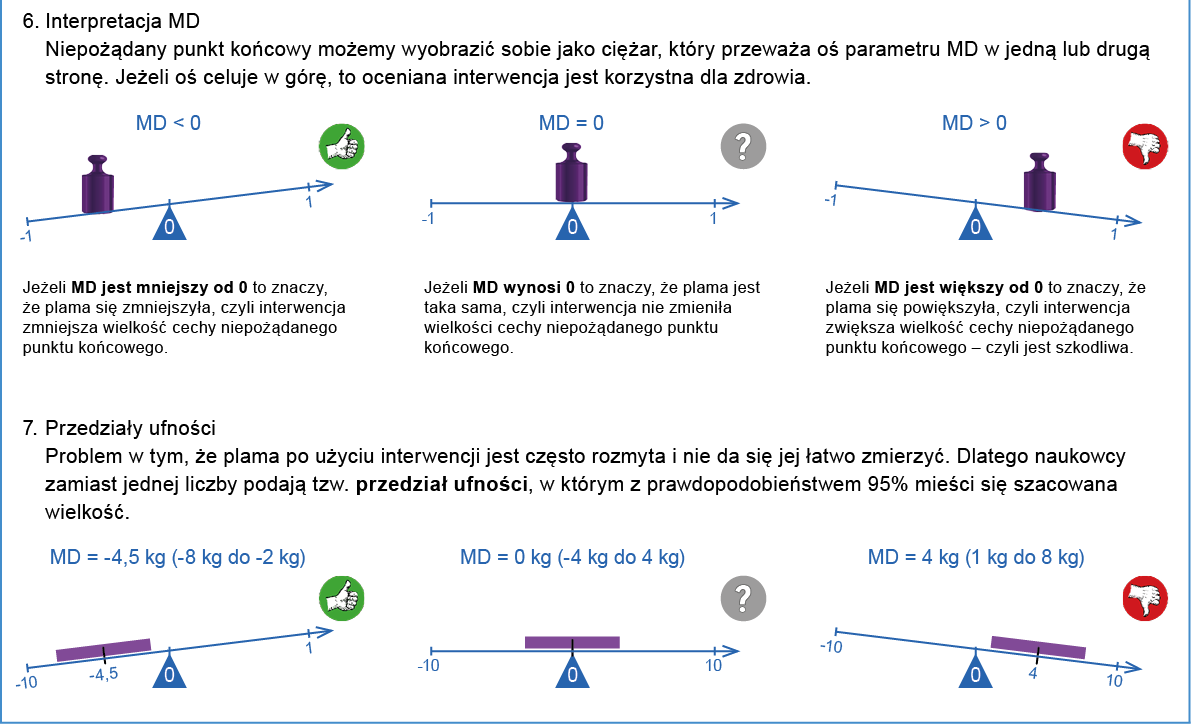
Przedział ufności jest zwykle wyrażany w procentach lub w formie zakresu wartości liczbowych. Zwykle podaje się 95% CI, czyli przedział, w którym z 95% pewnością znajduje się prawdziwa wartość danego parametru (np. RRR, NNT itd.) w badanej populacji. Jeśli w tym przedziale zawarte jest 0 dla różnicy ryzyka a 1 dla ryzyka względnego albo ilorazu szans, to jest to równoznaczne z brakiem istotności statystycznej danego wyniku (p >0,05). Forma przedstawiania wyników niosąca więcej informacji niż poziom istotności statystycznej (wartość p), gdyż dodatkowo informuje o najbardziej prawdopodobnej wielkości, kierunku i zakresie możliwych wartości zaobserwowanego efektu.
Miary skuteczności interwencji
W zależności od rodzaju ocenianych zmiennych wyniki metaanalizy przedstawia się przy użyciu różnych wielkości
- w przypadku zmiennych dychotomicznych (takich jak np. zgon lub ustąpienie objawów depresji) najczęściej oblicza się wartość ryzyka względnego (relative risk – RR), ilorazu szans (odds ratio – OR) lub korzyści względnej (relative benefit) – RB; rzadziej korzysta się z wartości bezwzględnych: bezwzględnego zmniejszenia ryzyka (absolute risk reduction – ARR) lub number needed to treat (NNT);
- W przypadku zmiennych ciągłych (np. zmiany masy ciała lub zmiany nasilenia objawów chromania przestankowego) stosuje się średnią ważoną różnic (weighted mean difference – WMD) lub standaryzowaną średnią różnic (standardized mean difference – SMD).
Miary efektu stosowane w ilościowych opisach wyników metaanaliz:
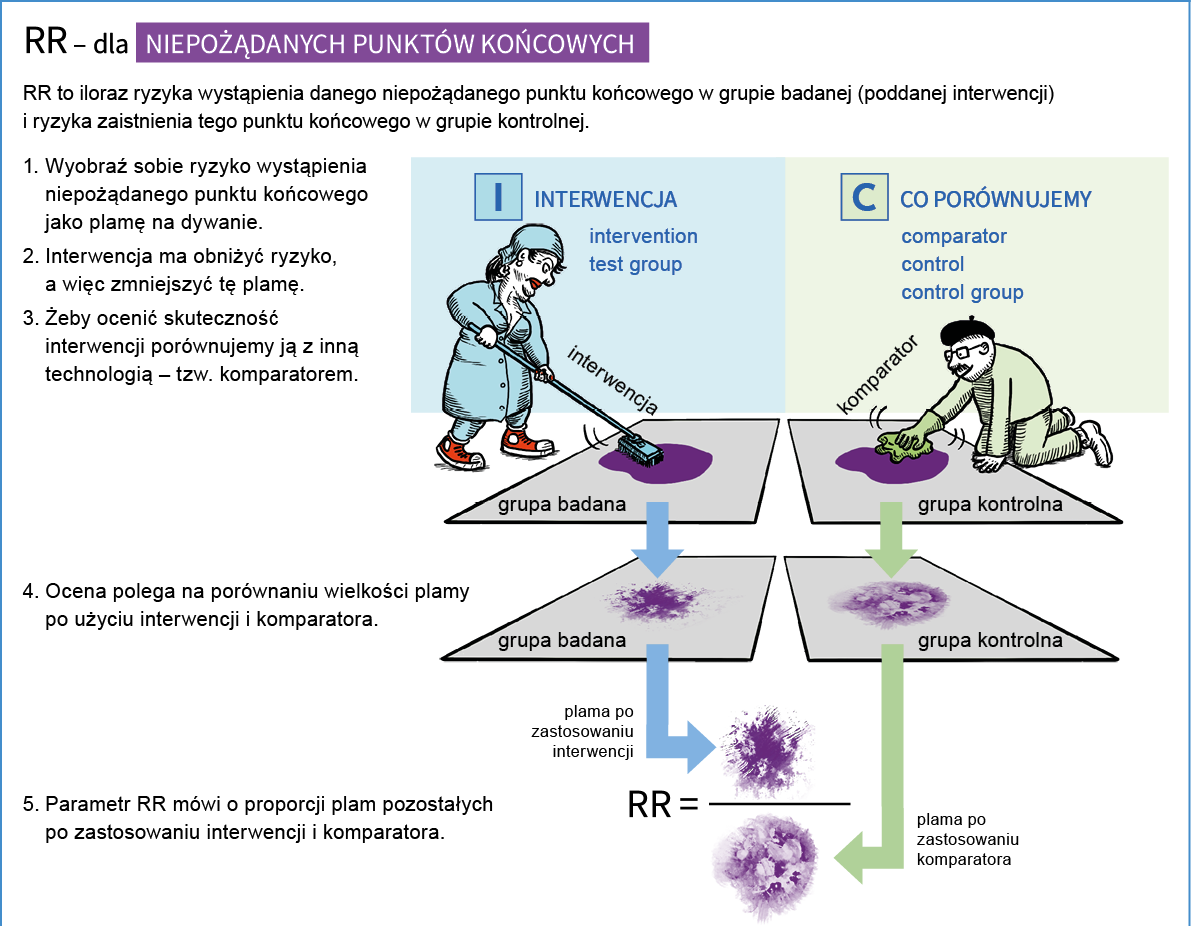
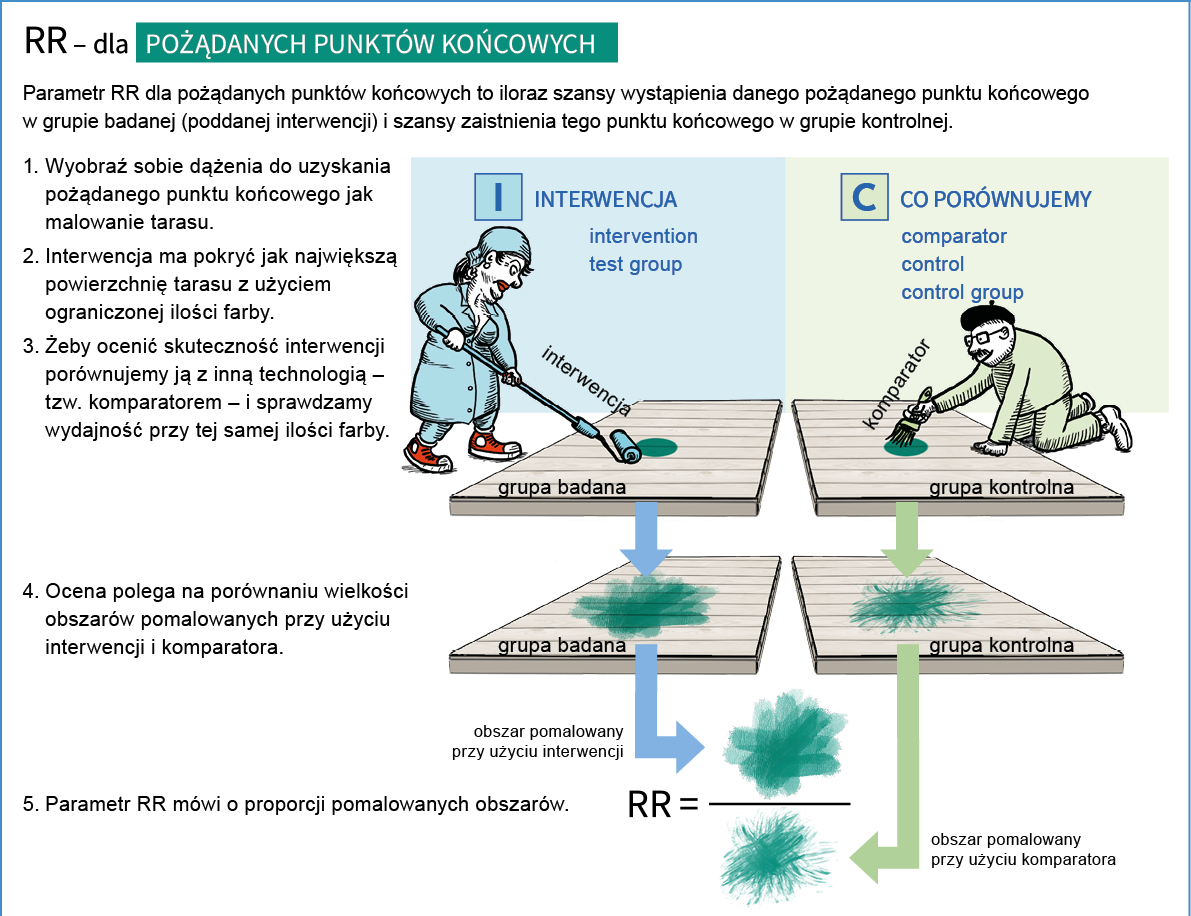
- Co oznacza miara efektu określona skrótem RR i jak ją rozumieć?
Ryzyko względne (RR) w badaniach klinicznych jest miarą porównującą ryzyko wystąpienia danego zdarzenia (np. choroby, zgonu, nawrotu) w grupie ludzi stosujących dane leczenie lub interwencję (np. szczepienie) z ryzykiem wystąpienia tego zdarzenia w grupie kontrolnej, która nie stosuje tego leczenia lub interwencji. RR jest stosunkiem ryzyka wystąpienia danego zdarzenia w grupie interwencyjnej do ryzyka wystąpienia tego zdarzenia w grupie kontrolnej. Wynik RR mniejszy niż 1 oznacza, że interwencja zmniejsza ryzyko wystąpienia danego zdarzenia, natomiast wynik RR większy niż 1 oznacza, że interwencja zmniejsza ryzyko wystąpienia danego zdarzenia. RR równe 1 oznacza, że stosunek ryzyka wynosi 1, co oznacza, że ryzyko zdarzenia w grupie badanej jest takie samo jak w grupie kontrolnej.
Przykładowo: Porównano ryzyko wystąpienia raka płuca w grupie osób palących tytoń i osób niepalących. Ryzyko względne wynoszące 1,5 oznacza, że osoby narażone na palenie tytoniu mają o 50% większe ryzyko wystąpienia raka płuca w porównaniu z osobami nie narażonymi na ten czynnik, a więc nie palącymi.
Przykład interpretacji ryzyka względnego poniżej 1: Ryzyko względne wynoszące 0,7 oznacza, że osoby narażone na określony czynnik mają o 30% mniejsze ryzyko wystąpienia danej choroby w porównaniu z osobami nie narażonymi na ten czynnik. Oznacza to, że “narażenie” na czynnik ten może być korzystne dla zdrowia i ma charakter ochronny i zmniejsza ryzyko zachorowania.
- Co oznacza miara efektu określona skrótem OR i jak ją rozumieć?
IIoraz szans (OR, odds ratio) w badaniach klinicznych jest miarą stosowaną do oceny efektu interwencji. Jest to stosunek szans wystąpienia zjawiska badanego w grupie interwencyjnej do szans wystąpienia tego samego zjawiska w grupie kontrolnej. Iloraz szans można interpretować jako wskaźnik o ile razy bardziej prawdopodobne jest wystąpienie zdarzenia w grupie interwencyjnej w porównaniu do grupy kontrolnej. Miara wykorzystywana do oceny skuteczności terapii w badaniach klinicznych.
- Co oznacza miara efektu określona skrótem HR i jak ją rozumieć?
Pod względem interpretacyjnym pojęcie analogiczne do RR. Jest wynikiem analizy krzywych lub tabeli przeżywalności. Określa względne prawdopodobieństwo zajścia jakiegoś zdarzenia w badanych grupach w określonym czasie przy założeniu, że zdarzenie to do tej pory nie wystąpiło. Określa część ryzyka podstawowego "pozostałą" po interwencji).
Iloraz prawdopodobieństwa wystąpienia danego (zazwyczaj niekorzystnego) punktu końcowego w grupie badanej oraz prawdopodobieństwa zaistnienia tego punktu końcowego w grupie kontrolnej.
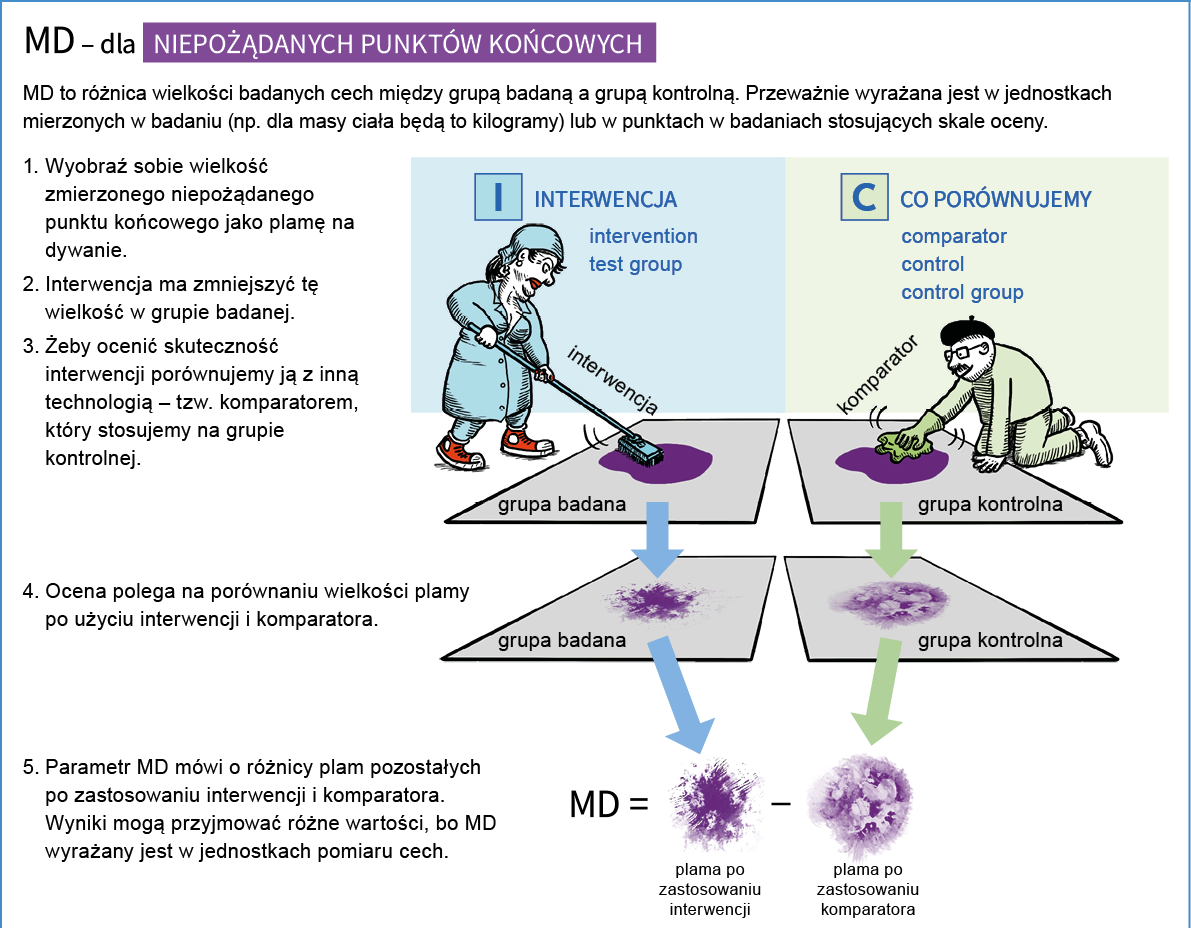
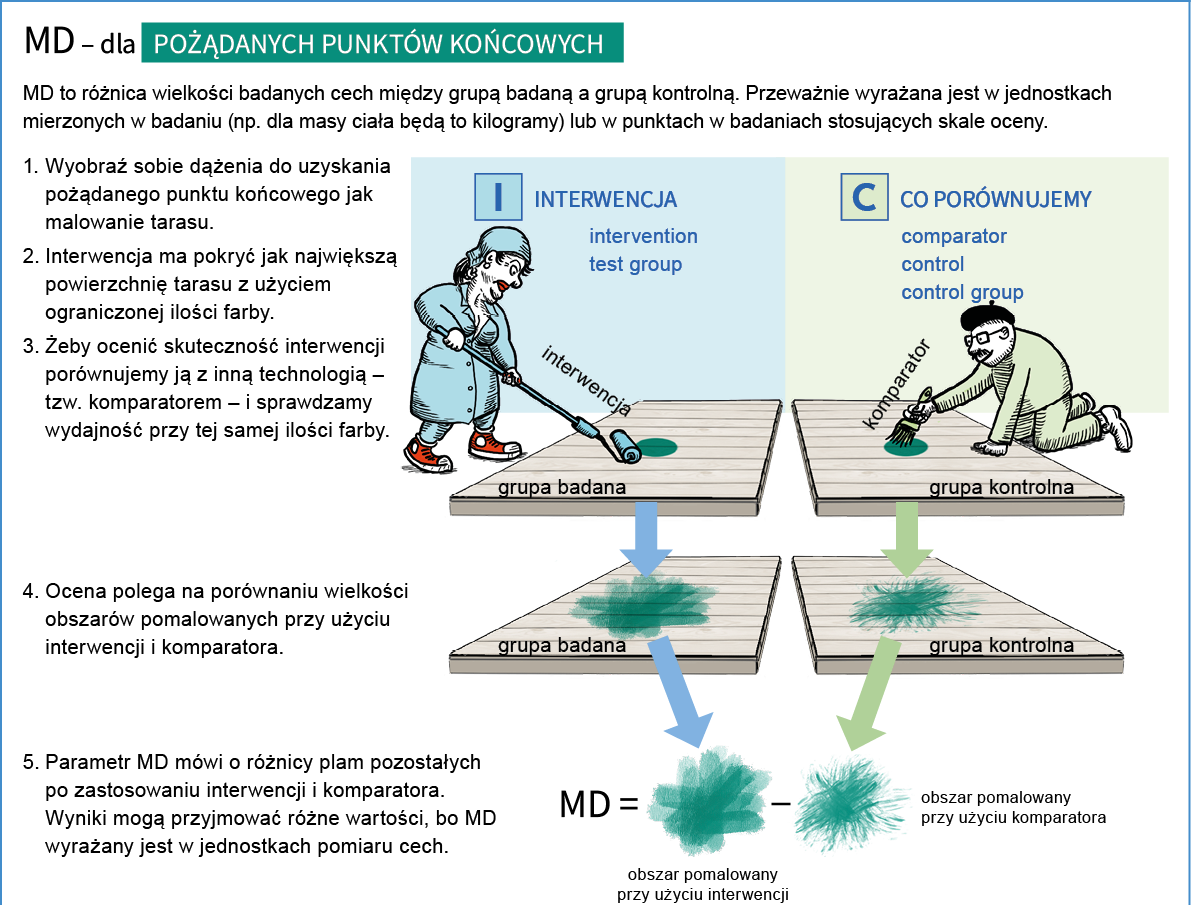
- MD (mean difference) – średnia ważona różnic
Miara różnicy między grupą badaną a grupą kontrolną uzyskanej w skali ciągłej (np. masy ciała), gdy we wszystkich badaniach pierwotnych włączonych do metaanalizy stosowano tę samą skalę pomiarową.
- SMD (standardized mean difference) – standaryzowana średnia różnic
Miara różnicy między grupą badaną a grupą kontrolną uzyskanej w skali ciągłej, gdy w badaniach pierwotnych włączonych do metaanalizy stosowano różne skale pomiarowe (np. zmniejszenia nasilenia depresji wyrażane w różnych skalach).
Jeśli powyższe definicje nie są zbyt jasne - poniżej przedstawiamy rysunkową interpretację miar efektu
MD
strona w budowie
Na co trzeba zwrócić uwagę kiedy czyta się meta-analizę? Na jednorodność badań, wyrażone przez parametr I2
Przegląd systematyczny ma na celu zebranie wszystkich dostępnych badań w ściśle zdefiniowanym temacie. Ale pomimo precyzyjnego pytania badawczego w przeglądzie może zdarzyć się, że badania włączone do przeglądu są niejednorodne. Nie oznacza to, że kryteria włączenia i wykluczenia były źle zastosowane, albo selekcja źle przeprowadzona. Niejednorodność oznacza to, że badania, które zostały uwzględnione w przeglądzie systematycznym lub metaanalizie, mogą różnić się od siebie pod względem różnych czynników, takich jak projekt badawczy, metody analizy danych, populacja badana, sposób dostarczania interwencji itp.
Na przykład w jednych badaniach włączano populację dorosłych a w innych dzieci i wyniki pomiędzy tymi populacjami różnią się. Również sposób dostarczania interwencji może wpłynąć na wyniki. Przykładowo podawanie leków doustnie lub dożylnie, albo prowadzenie poradnictwa przed pielęgniarki albo lekarzy, albo udzielanie świadczenia ambulatoryjnie lub w ramach hospitalizacji.
Niejednorodność badań może wpłynąć na wyniki przeglądu systematycznego, ponieważ może prowadzić do sprzecznych wyników, trudności w syntezie danych i wyciąganiu jednoznacznych wniosków. Aby zaradzić temu problemowi, należy dokładnie analizować czynniki wpływające na niejednorodność badań i stosować odpowiednie metody syntezy danych, analizować wyniki w podgrupach, aby zminimalizować wpływ tej niejednorodności na ostateczne wnioski przeglądu systematycznego.
I2 = 0–40% ⇒ prawdopodobnie nieistotna niejednorodność;
I2 = 30–60% ⇒ niejednorodność umiarkowana (której przyczyny wymagają dokładniejszego zbadania);
I2 = 50–90% ⇒ duża niejednorodność (której źródła należy zidentyfikować i opisać);
I2 = 75–100% ⇒ w takich przypadkach łączną analizę danych można przeprowadzić jedynie przy zachowaniu szczególnej ostrożności i obiektywizmu interpretacyjnego.
Dlaczego przedziały ufności są czasem szerokie a czasem wąskie? Szerokość przedziału ufności wyraża precyzję
Szeroki przedział ufności może świadczyć o dużej zmienności danych w próbie oraz mniejszej pewności co do estymacji (oszacowania) parametru w populacji ogólnej. Z kolei wąski przedział ufności może wskazywać na niewielką zmienność danych w próbie oraz większą pewność co do estymacji parametru. Im węższy jest przedział ufności, tym większa jest pewność, że wynik badania jest dokładny.
Dlaczego czasem autorzy meta-analiz wykonują czasem całą serię meta-analiz wydzielając niektóre badania?
Kiedy mamy dużą heterogenność (współczynnik I^2 >50) włączonych badań, to podstawowym działaniem powinna być próba jej wytłumaczenia przez tzw. analizę podgrup. Czasem da się znaleźć jej przyczynę przeprowadzając dodatkową analizę np. osobno do grupy z bardzo wysokim ciśnieniem a osobno dla tych z niewielkim nadciśnieniem, albo osobno dla osób z nadwagą a osobno dla osób z otyłością. Bardzo często przyczyna heterogenności jest w różnicach pomiędzy badaniami, np. Jedne badania podawały wyższą dawkę leku a inne niższą, może różniły się względem formy podawania leku (np. Dożylnie vs. Doustnie). Kiedy “trafimy” przyczynę heterogenność nagle spada w obydwu grupach i możemy doprecyzować nasze wnioski. Jeśli jednak nie udało się, pomimo prób, to jedynie co należy zrobić to otwarcie przyznać, że wynik jest obarczony znaczną różnorodnością między badaniami, która nie wynika z przyczyn tylko losowych, więc wynik należy interpretować odpowiednio ostrożnie, a pewność co do niego obniżyć.
Czemu jedne przeglądy zawierają meta-analizy a inne tylko opisy?
Istnieje kilka rodzajów przeglądów systematycznych, które różnią się metodami i celami. Przeglądy narracyjne polegają na jakościowej syntezie wyników badań, bez formalnej analizy statystycznej. Przeglądy z metaanalizą łączą wyniki wielu badań ilościowych za pomocą metod statystycznych, co pozwala na bardziej precyzyjne oszacowanie efektów danego zjawiska lub interwencji. Przeglądy typu „scoping review” mają na celu identyfikację i mapowanie kluczowych pojęć czy danych naukowych w danym obszarze badawczym, często w celu zdefiniowania potrzeb w zakresie przyszłych badań. Przeglądy typu „rapid review” (szybkie przeglądy) są przede wszystkim wykonywane w ciągu maksymalnie 48 godzin. Ich metodologia pozwala na zastosowanie pewnych uproszczeń i służą jako pomoc w podejmowaniu szybkich decyzji, np. w czasie pandemii. Istnieją również przeglądy dedykowane tylko badaniom jakościowym, które skupiają się np. na ocenie zmian w obrębie jakości życia lub preferencjach. Takie przeglądy zwykle nie zawierają żadnych obliczeń, a jedynie opisy. Wreszcie, istnieją przeglądy, które określa się mianem „mixed methods”, łączące zarówno metody jakościowe, jak i ilościowe
Jak rozumieć wynik przeglądu systematycznego który stwierdza, że nie mamy dobrych danych aby wysnuć jednoznaczny wniosek?
Często przeglądy systematyczne w swoim podsumowaniu zawierają zdanie: „nie mamy dobrej jakości danych, by jednoznacznie...”. Oznacza to, że potrzebne są kolejne, lepszej jakości badania, by móc odpowiedzieć jednoznacznie na zadane pytanie. Jest to komunikat dla naukowców, na jakich tematach powinni się skupić, a dla czytelników przypomnienie, że brak danych lub niewystarczające dane nie są dowodem na to, że interwencja nie działa
Gdzie jest miejsce pacjenta w badaniach takich jak przeglądy systematyczne?
Organizacja Cochrane od dawna promuje włączanie pacjentów w proces tworzenia swoich publikacji. Doświadczenie i punkt widzenia pacjentów, opiekunów i członków rodzin pacjentów, którzy mają bezpośrednie doświadczenie w zakresie opieki zdrowotnej, są niezwykle istotne dla badaczy prowadzących badania. Pacjenci, czy ogólniej mówiąc 'konsumenci' ochrony zdrowia, mają prawo wiedzieć o badaniach i móc wpływać na ich przebieg. Po pierwsze, ponieważ badania Cochrane opierają się na funduszach publicznych, taka kooperacja buduje zaufanie do tego, jak przeglądy są tworzone. Po drugie, Cochrane podkreśla, że włączanie konsumentów/pacjentów podnosi jakość przeglądów głównie dlatego, że dzięki nim przeglądy odpowiadają na pytania istotne z punktu widzenia pacjentów, które mają szansę przełożyć się na jakość życia osób, których bezpośrednio dotyczą.
Cochrane
Organizacja Cochrane - skąd się wzięła?
Cochrane jest międzynarodową siecią z siedzibą w Wielkiej Brytanii, zarejestrowaną jako organizacja non-profit i członkiem UK National Council for Voluntary Organizations.
Cochrane jest dla każdego, kto jest zainteresowany wykorzystaniem wysokiej jakości informacji w podejmowaniu decyzji dotyczących zdrowia. Niezależnie od tego, czy jesteś klinicystą, pacjentem czy opiekunem, naukowcem czy politykiem, dane naukowe Cochrane dostarczają skutecznego narzędzia do wzmacniania Twojej wiedzy oraz podejmowanych decyzji z zakresu opieki zdrowotnej.
Cochrane obejmuje członków i współpracowników, którzy pochodzą z ponad 190 krajów na całym świecie. To organizacja zrzeszająca naukowców, pracowników ochrony zdrowia, pacjentami, opiekunów i osoby zainteresowane poprawą wyników w zakresie zdrowia dla każdego na całym świecie. Ta globalna, niezależna sieć zbiera i podsumowuje najlepsze dane naukowe pochodzące z badań w celu ułatwiania podejmowania decyzji dotyczących leczenia i robimy to od 30 lat.
Cochrane nie akceptuje finansowania komercyjnego lub wiążącego się z konfliktem interesów. Bardzo ważnym jest dla Cochrane, aby tworzyć wiarygodne i rzetelne informacje, współpracować swobodnie, bez ograniczeń wynikających z interesów handlowych i finansowych.
Czym zajmuje się organizacja Cochrane?
Organizacja Cochrane zajmuje się tworzeniem specjalnego typu publikacji naukowych, które nazywają się „przeglądy systematyczne”. Czuwa nad rozwojem metodologii umożliwiającej ich tworzenie oraz promuje ich wyniki. Cochrane dostarcza również zasobów i szkoleń dla swoich współpracowników, umożliwiając im przygotowywanie i aktualizowanie przeglądów zgodnie z wytycznymi zawartymi w podręczniku do ich tworzenia, Cochrane Handbook.
Kim był Archie Cochrane
Profesor Archibald Leman Cochrane (1909–1988), brytyjski epidemiolog, był jednym z pierwszych propagatorów idei wykorzystywania danych naukowych do podejmowania decyzji w praktyce klinicznej. Zauważył, że chociaż istnieje wiele publikacji na jeden temat, brakuje rzetelnych i krytycznych podsumowań, które mogłyby ocenić, czy dana interwencja medyczna przynosi korzyści w codziennej opiece. Cochrane podkreślał, że takie podsumowania powinny być regularnie aktualizowane, aby korzystać z najnowszych dostępnych danych oraz identyfikować obszary, gdzie informacje są niedostateczne lub słabej jakości. To podejście umożliwiłoby planowanie i przeprowadzanie nowych, lepszej jakości badań. Na cześć profesora nazwano organizację non-profit, która tworzy takie podsumowania badań, zwane przeglądami systematycznymi (SR)
Polska gałąź organizacji Cochrane i PLS
Cochrane Polska funkcjonuje w ramach Ośrodka Przeglądów Systematycznych-Polskiej Filii Cochrane na Wydziale Lekarskim w Collegium Medicum Uniwersytetu Jagiellońskiego w Polsce. Członkowie Rady Doradczej pracują na Uniwersytecie Jagiellońskim oraz na innych uczelniach w kraju i za granicą.
Cele Cochrane Polska:
- Promować i reprezentować Cochrane w Polsce oraz uczestniczyć w działaniach międzynarodowych organizacji.
- Udzielać informacji na temat Cochrane i jej działań.
- Umożliwiać szkolenia i zapewniać wsparcie współpracownikom Cochrane w zwiększaniu zdolności do przygotowywania i aktualizowania w Polsce przeglądów systematycznych Cochrane o wysokiej jakości.
- Promować dostęp do Biblioteki Cochrane.
- Promować wykorzystywanie przeglądów Cochrane w codziennej praktyce jako podstawy do podejmowania decyzji klinicznych.
Członkowie jak i osoby wspierające Cochrane Polska promują działania Cochrane na różnych wydarzeniach – konferencjach, szkoleniach, webinarach, seminariach ze studentami. Prowadzą szkolenia z zakresu opracowywania wiarygodnych przeglądów systematycznych. Członkowie pracują również nad dostępnością materiałów Cochrane Collaboration tłumacząc stronę Cochrane jak i streszczenia prostym językiem tzw. PLS przeglądów systematycznych z j. angielskiego na j. polski.
Każda osoba zainteresowana – zarówno student, profesjonalista, lekarz, pielęgniarka, osoba pracująca w zakresie ochrony zdrowia może wspierać działania Cochrane poszerzając zarówno swoje horyzonty jak i zwiększać świadomość w społeczeństwie o produktach tworzonych przez Cochrane.
Gdybym chciał uczestniczyć - czy jest możliwość zaangażowania się w Cochrane?
Streszczenia prostym językiem (PLSs) pomagają ludziom zrozumieć i zinterpretować wyniki badań i są one częścią każdego przeglądu Cochrane. PLSs są tworzone przy użyciu standardowej zawartości, struktury i języka, aby ułatwić ich zrozumienie i tłumaczenie. Opublikowanych jest blisko 7000 PLSs z różnych obszarów zdrowia:
- Alergia i nietolerancja
- Zaburzenia krwi
- Nowotwory
- Zdrowie dzieci
- Medycyna alternatywna i komplementarna
- Strategie konsumenckie i komunikacyjne
- Stomatologia i zdrowie jamy ustnej
- Problemy rozwojowe, psychospołeczne i edukacyjne
- Diagnostyka
- Ucho, nos i gardło
- Efektywna praktyka i system ochrony zdrowia
- Endokrynologia i metabolizm
- Oczy i wzrok
- Gastroenterologia i hepatologia
- Zaburzenia genetyczne
- Ginekologia
- Zdrowie i bezpieczeństwo w pracy
- Układ sercowo-naczyniowy
- Choroby zakaźne
- Choroby nerek
- Płuca i drogi oddechowe
- Zdrowie psychiczne
- Metodologia
- Opieka neonatologiczna
- Neurologia
- Ortopedia i traumatologia
- Ból i leczenie przeciwbólowe
- Ciąża i poród
- Zdrowie publiczne
- Reumatologia
- Choroby skóry
- Tytoń, narkotyki i alkohol
- Urologia
- Rany i skaleczenia
Cochrane to niesamowita globalna społeczność. Nasi członkowie i zwolennicy na całym świecie pracują wspólnie nad poprawą zdrowia i opieki zdrowotnej dla wszystkich. Robimy to, poprzez opieranie decyzji dotyczących zdrowia o wiarygodne dane naukowe. Jeśli podzielasz naszą wizję, dołącz do naszej globalnej społeczności i wspieraj pracę Cochrane.
Jak dołączyć do organizacji Cochrane?
Dołącz dziś jako Wspierający Cochrane. Każdy Wspierający, który uczestniczy w naszej pracy, może zostać Członkiem Cochrane. Praca, aby otrzymać członkostwo w Cochrane jest doskonałą okazją do rozwijania nowych umiejętności i wprowadzania zmian w dziedzinie danych zdrowotnych.
Istnieje wiele sposobów, aby pomóc Cochrane w pracy i zdobyć Członkostwo w Cochrane. Nasze automatycznie systemy dodają punkty członkowskie za publikacje, recenzje oraz zadania wykonane w ramach Cochrane Crowd i Cochrane Engage. Jeśli przyczyniłeś się do pracy Cochrane w sposób, który nie został poniżej opisany, poinformuj nas o tym.
Tylko około 6% ludności świata mówi po angielsku, podczas gdy 75% ludzi w ogóle nie mówi po angielsku.
Wiele osób nie ma dostępu do wysokiej jakości informacji na temat zdrowia, ponieważ nie są one łatwo dostępne w zrozumiałym dla nich języku. Tłumaczymy dane naukowe opublikowane przez Cochrane, aby uczynić je bardziej dostępnymi i zmniejszyć barierę językową w podejmowaniu globalnych decyzji dotyczących zdrowia opartych na danych naukowych.
Kilkaset wolontariuszy przetłumaczyło już tysiące przeglądów Cochrane na ich języki.
Obecnie poszukujemy wolontariuszy do tłumaczenia z języka angielskiego na następujące języki:
- chiński (uproszczony i tradycyjny)
- chorwacki
- francuski
- węgierski
- indonezyjski
- japoński
- koreański
- malajski
- perski
- polski
- rumuński
- rosyjski
- tajski
Jeśli chcesz przyczynić się tłumaczenia w jednym z powyższych języków, przeczytaj więcej na stronie cochrane.org i dołącz do projektu tłumaczeń, kliknij poniżej "Zostań tłumaczem". Zostaniesz przekierowany na stronę 'Moje konto', gdzie zostaniesz poproszony o założenie konta Cochrane. Jeśli posiadasz już konto Cochrane, możesz zalogować się.
Gdzie i jak szukać badań?
Z jakich linków korzystać do poszukiwania badań?
Darmowa baza PubMed
Darmowa baza - szczególnie dobra do wyszukiwania przeglądów systematycznych:
Scholar google znacznie lepsza wyszukiwarka niż “zwykłe google”
