Przegląd systematyczny jako źródło wiarygodnej wiedzy klinicznej
Poszukując rozwiązań problemów klinicznych, warto odwoływać się do wyników przeglądów systematycznych (systematic reviews). Korzystanie z przeglądów systematycznych w codziennej pracy lekarskiej ułatwia podejmowanie trafnych decyzji, gdyż "połączenie wyników badań, w których wzięli udział nieco różniący się chorzy lub inaczej zdefiniowano punkty końcowe, umożliwia rozszerzenie wniosków z poszczególnych badań na większą populację, co pozwala na szersze wykorzystanie ich wyników w praktyce".[1]
Przegląd systematyczny jest badaniem wtórnym (podsumowującym wyniki badań pierwotnych), opracowanym zgodnie z rygorystycznymi standardami metodologicznymi, pozwalającymi zminimalizować ryzyko zaistnienia błędów systematycznych (bias).[1, 2] Dlatego też obecnie uważa się, że wyniki przeglądów systematycznych zajmują jedno z czołowych miejsc w hierarchii wiarygodności danych klinicznych (por. ramka 1.).[3, 4]
Wyróżnia się dwa rodzaje przeglądów systematycznych:
- opisowe – bez ilościowej analizy wyników badań pierwotnych;
- ilościowe – których zwieńczeniem jest metaanaliza (ilościowa synteza wyników badań włączonych do przeglądu systematycznego).[1]
Ramka 1. Hierarchia wiarygodności danych |
|
N-of-1 RCT (randomized controlled trials in individual patients) – badania z randomizacją z udziałem pojedynczych chorych PIO (patient-important outcomes) – efekty leczenia ważne z punktu widzenia chorych RCT (randomized controlled trials) – badanie(a) z randomizacją |
| Za: 4. pozycją piśmiennictwa. |
Od badań pierwotnych do przeglądu systematycznego
Zdaniem Murada i wsp. wyniki przeglądu systematycznego „stanowią odpowiedź na precyzyjnie sformułowane pytanie kliniczne, udzieloną w ustrukturyzowany, odtwarzalny sposób”.[5]
Na proces tworzenia przeglądu systematycznego składa się osiem lub dziewięć kroków:
- sformułowanie pytania klinicznego według schematu PICO:
- P: rozpoznanie choroby (patient’s diagnosis) lub populacja włączona do badania (population);
- I: interwencja lub leczenie zastosowane w grupie badanej (intervention);
- C: interwencja lub leczenie zastosowane w grupie kontrolnej (comparison or control intervention);
- O: punkt końcowy badania (outcome),
- określenie klinicznych (⇒ PICO) oraz metodologicznych kryteriów włączania badań do przeglądu systematycznego,
- sformułowanie hipotezy a priori, przybliżającej do wyjaśnienia niejednorodności wyników badań,
- wyczerpujący przegląd piśmiennictwa,
- wstępna ocena streszczeń znalezionych badań,
- kwalifikacja badań (na podstawie oceny treści manuskryptów),
- ocena badań pod względem ich wiarygodności (ryzyka zaistnienia błędów systematycznych – bias),
- ekstrakcja danych,
- przeprowadzenie metaanalizy (co nie zawsze jest możliwe lub właściwe).[5]
Kryteria wiarygodności
Przegląd można uznać za wiarygodny, jeżeli:[1]
- pozwala odpowiedzieć na adekwatne i precyzyjnie sformułowane pytanie kliniczne,
- jego autorzy przeprowadzili wyczerpujący przegląd piśmiennictwa (korzystając co najmniej z trzech baz danych: MEDLINE, EMBASE i Cochrane Central Register of Controlled Trials),
- jego autorzy przeanalizowali badania pierwotne pod kątem ryzyka wystąpienia błędów systematycznych oraz określili stopień wiarygodności poszczególnych badań,
- proces wyboru i oceny badań pierwotnych był powtarzalny.
Metaanaliza
Metaanaliza stanowi ilościową syntezę wyników badań pierwotnych. Warunkiem przeprowadzenia metaanalizy jest jednorodność badań włączonych do przeglądu systematycznego.
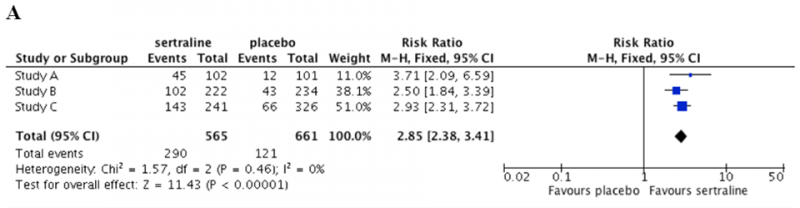
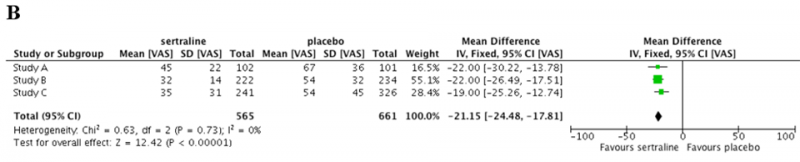
Graficzną formą przedstawienia wyników metaanalizy jest wykres typu forest plot (zwany też wykresem Cochrane’a lub wykresem metaanalizy; por. Ramka 2.).[1]
Ramka 2. Graficzna prezentacja wyników metaanalizy* |
A. Dla zmiennej dychotomicznej (prawdopodobieństwo uzyskania remisji objawów depresyjnych)
|
B. Dla zmiennej ciągłej (zmiana nasilenia objawów depresyjnych)
|
| *Przykłady opracowane dla celów szkoleniowych (niebędące odzwierciedleniem „faktycznie” przeprowadzonych badań). |
W zależności od rodzaju ocenianych zmiennych wyniki metaanalizy przedstawia się przy użyciu różnych wielkości (por. Tabela 1):[1, 6]
- w przypadku zmiennych dychotomicznych (takich jak np. zgon lub ustąpienie objawów depresji) najczęściej oblicza się wartość ryzyka względnego (relative risk – RR), ilorazu szans (odds ratio – OR) lub korzyści względnej (relative benefit) – RB; rzadziej korzysta się z wartości bezwzględnych: bezwzględnego zmniejszenia ryzyka (absolute risk reduction – ARR) lub number needed to treat (NNT);
- W przypadku zmiennych ciągłych (np. zmiany masy ciała lub zmiany nasilenia objawów chromania przestankowego) stosuje się średnią ważoną różnic (weighted mean difference – WMD) lub standaryzowaną średnią różnic (standardized mean difference – SMD).
Tabela. Miary efektu stosowane w ilościowych opisach wyników metaanaliz [1, 6] | |
| ARR (absolute risk redution) – bezwzględne zmniejszenie ryzyka; zwane też różnicą ryzyka (risk difference) | Bezwzględna różnica między ryzykiem zaistnienia danego punktu końcowego w grupie badanej a analogicznym ryzykiem w grupie kontrolnej. |
| NNT (number needed to treat) | Liczba osób, które trzeba poddać danej metodzie leczenia przez pewien czas, by uzyskać jeden dodatkowy korzystny punkt końcowy lub by zapobiec wystąpieniu jednego dodatkowego niekorzystnego zdarzenia. |
| OR (odds ratio) – iloraz szans | Iloraz szansy wystąpienia danego punktu końcowego w grupie badanej oraz szansy zaistnienia tego punktu końcowego w grupie kontrolnej. |
| RB (relative benefit) – korzyść względna | Iloraz prawdopodobieństwa wystąpienia danego korzystnego punktu końcowego w grupie badanej oraz prawdopodobieństwa zaistnienia tego punktu końcowego w grupie kontrolnej. |
| RR (relative risk) – ryzyko względne | Iloraz prawdopodobieństwa wystąpienia danego (zazwyczaj niekorzystnego) punktu końcowego w grupie badanej oraz prawdopodobieństwa zaistnienia tego punktu końcowego w grupie kontrolnej. |
| SMD (standardized mean difference) – standaryzowana średnia różnic | Miara różnicy między grupą badaną a grupą kontrolną uzyskanej w skali ciągłej, gdy w badaniach pierwotnych włączonych do metaanalizy stosowano różne skale pomiarowe (np. zmniejszenia nasilenia depresji wyrażane w różnych skalach). |
| MD (mean difference) – średnia ważona różnic | Miara różnicy między grupą badaną a grupą kontrolną uzyskanej w skali ciągłej (np. masy ciała), gdy we wszystkich badaniach pierwotnych włączonych do metaanalizy stosowano tę samą skalę pomiarową. |
Jednym z istotnych aspektów oceny wiarygodności przeglądu systematycznego jest konieczność określenia, w jakiej mierze wyniki poszczególnych badań pierwotnych wpływają na wyniki metaanalizy oraz czy te wyniki są jednorodne. Informacji na temat niejednorodności wyników (heterogeneity of results) dostarcza test statystyczny I2, opisujący, w jakim stopniu różnice w oszacowaniu efektu wynikają z niejednorodności wyników badań, a w jakim można je uznać za dzieło przypadku:[1]
- I2 = 0–40% ⇒ prawdopodobnie nieistotna niejednorodność;
- I2 = 30–60% ⇒ niejednorodność umiarkowana (której przyczyny wymagają dokładniejszego zbadania);
- I2 = 50–90% ⇒ duża niejednorodność (której źródła należy zidentyfikować i opisać);
- I2 = 75–100% ⇒ w takich przypadkach łączną analizę danych można przeprowadzić jedynie przy zachowaniu szczególnej ostrożności i obiektywizmu interpretacyjnego.
Piśmiennictwo
- Leśniak W, Bała M, Mrukowicz J, Brożek J, Jaeschke R, Gajewski P. Przegląd systematyczny i metaanaliza. In: Gajewski P, Jaeschke R, Brożek J, eds. Podstawy EBM, czyli medycyny opartej na danych naukowych dla lekarzy i studentów medycyny. Kraków: Medycyna Praktyczna; 2008:111-126.
- Guyatt G, Jaeschke R, Prasad K, Cook DJ. Summarizing the Evidence. In: Guyatt G, Rennie D, Meade MO, Cook DJ, eds. Users’ Guides to the Medical Literature: A Manual for Evidence-Based Clinical Practice: McGraw-Hill; 2008:523-542.
- Guyatt G, Haynes B, Jaeschke R, et al. The Philosophy of Evidence-Based Medicine. In: Guyatt G, Rennie D, Meade MO, Cook DJ, eds. Users’ Guides to the Medical Literature: A Manual for Evidence-Based Clinical Practice: McGraw-Hill; 2008:9-16.
- Jaeschke R. Wiedza i życie (kliniczne). Notatki na marginesie debaty o polifarmakoterapii. Medycyna Praktyczna – Psychiatria. 2014(4):25-29.
- Murad MH, Montori VM, Ioannidis JP, et al. How to read a systematic review and meta-analysis and apply the results to patient care: users’ guides to the medical literature. JAMA: the journal of the American Medical Association. 2014;312(2):171-179.
- Leśniak W, Brożek J, Jaeschke R, Gajewski P, Bała M, Mrukowicz J. Ocena informacji o metodzie leczniczej, rokowaniu lub szkodliwości. In: Gajewski P, Jaeschke R, Brożek J, eds. Podstawy EBM, czyli medycyny opartej na danych naukowych dla lekarzy i studentów medycyny. Kraków: Medycyna Praktyczna; 2008:53-96.